2022年03月07日中外香料香精第一资讯浏览量:0
侧柏酮—苦艾酒的重要成分;少量能使意识进入到奇幻国度,产生朦胧快感,激发出创造潜能。研究报告指出,侧柏酮会抑制人体制造神经传导物质GABA(Gamma-amino butyric acid)γ-氨基丁酸。GABA可以抑制或阻断神经细胞过度兴奋,让人的身心状态宁静、平和及放松下来。如果缺少GABA,会造成失眠、精神紧张、歇斯底里等精神异常状况。这也就是误用高剂量侧柏酮后的中毒状况。自然界中有α-和β-两种异构体。[1]
表1 侧柏酮的功效及来源
| 中文名称 | α-侧柏酮 | β-侧柏酮 |
| 英文名称 | α-Thujone | β-Thujone |
| 精油来源 | 侧柏、鼠尾草、艾草 | 南木蒿 |
| 气味描述 | 清新甜美 | 清澈、苦味、带有沙尘感 |
| 芳疗功效 | 兴奋中枢神经系统、通经、促进细胞再生 | 与α型相同,但是效果减弱许多,因此较无神经毒性 |
| 心灵功效 | 在狂乱与平静中找寻平衡 | 内心无限宽广、扩大 |
| 注意事项 |
| |
侧柏酮(英语:Thujone)又称“崖柏酮”或“守酮”,是一种酮以及一种单萜,天然存在于两个非对映体形式:(−)-α-侧柏酮和(+)β-侧柏酮。侧柏酮类似有薄荷醇的气味。尽管有关侧柏酮最广为人知的是,它是苦艾酒中所含的一种化学物质,但最近的研究表明苦艾酒只含有少量侧柏酮,所以侧柏酮可能不是报道中提及的苦艾酒能致幻的原因。侧柏酮能作用于大脑中的GABA受体和5-HT3受体。许多国家都对食物或饮料中侧柏酮的含量的都做了限制。除了天然的(−)-α-侧柏酮和(+)β-侧柏酮的,理论上侧柏酮还存在另外两个对映体形式:(+)-α-侧柏酮和(−)β-侧柏酮:[2]
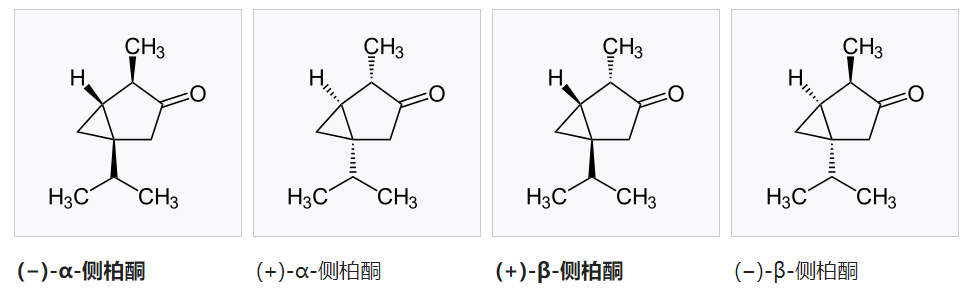
IUPAC名:α: (1S,4R,5R)-4-Methyl-1-(propan-2-yl)bicyclo[3.1.0]hexan-3-one
β: (1S,4S,5R)-4-methyl-1-(propan-2-yl)bicyclo[3.1.0]hexan-3-one
CAS号: 471-15-8(β-侧柏酮) 546-80-5(α-侧柏酮)
PubChem:261491,11027
ChemSpider:229574 (α-侧柏酮), 82583 (β-侧柏酮)
InChIKey:USMNOWBWPHYOEA-MRTMQBJTBZ
ChEBI:9577
化学式:C10H16O
摩尔质量:152.23 g·mol(-1)
密度:0.92 g/cm³(β-侧柏酮)
沸点:201 ℃(β-侧柏酮)
若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。
侧柏酮的应用
CN201811394406.7公开了一种负氧离子纳米净醛喷剂,包括以下重量组份:亲核去醛原料10-18份、离子水30-55份、物理去醛原料8-15份、氧化去醛原料12-25份、光触媒去醛原料10-13份与杀菌原料5-8份、防辐射原料6-11份;亲核去醛原料包括以下重量组份:异丙胺3-5份、苯酚8-16份与氨溶液6-12份;物理去醛原料包括以下重量组份:无机纳米硅8-14份、硅藻纯3-6份与纳米矿晶6-12份;防辐射原料包括以下重量组份:茶多酚5-10份、侧柏酮2-8份与前花青素3-4份。本发明能够达到四重净化甲醛的效果,分别通过物理阻碍方法、氧化反应方法、亲核反应方法与光触媒方法来阻碍甲醛扩散与甲醛中和反应生成二氧化碳与水,该喷剂还具有防辐抗癌,提神驱寒等对身体健康有益的功效。[3]
CN201610417280.5公开一种基于香料阈值的木香香型烟用香精及其调配方法,其由下述重量百分比的原料组成:香基1-20%,溶剂80-99%;其中,香基各组分的重量份组成见如下:侧柏酮0.5-5.0份、柏木醇0.1-2.0份、乙酸松油酯0.5-5.0份、愈创木醇0.5-5.0份、愈创木酚0.1-2.5份、广藿香醇0.1-1.0份、香紫苏内酯0.2-3.0份。将本发明木香香型烟用香精添加到烟丝中,采用本领域常规技术制成卷烟产品,感官评价试验结果表明:和未添加本发明木香香型烟用香精的空白样相比,添加后的卷烟样品香气质变好,香气量明显增加,且改善了余味,掩盖了杂气。[4]
(-)-α-侧柏酮
| 常用名 | (-)-α-侧柏酮 | 英文名 | α-Thujone |
| CAS号 | 546-80-5 | 分子量 | 152.23300 |
| 密度 | 0.914 g/mL at 20ºC(lit.) | 沸点 | 84-86ºC17 mm Hg(lit.) |
| 分子式 | C10H16O | 熔点 | 181ºC |
| 闪点 | 148 °F |
α-侧柏酮 是一种从西方金钟柏精油中分离出来的单萜,具有有效的抗肿瘤活性。α-侧柏酮 是 GABAA 受体的可逆调节剂,在抑制 GABA 诱导的电流时,α-侧柏酮 的 IC50 为 21 μM。α-侧柏酮诱导ROS依赖性细胞毒性,还诱导细胞凋亡 (apoptosis ) 和自噬 (autophagy)。α-侧柏酮具有抗伤害,杀虫和驱虫活性,并且很容易穿透血脑屏障。
(-)-α-侧柏酮物理化学性质
| 密度 | 0.914 g/mL at 20ºC(lit.) |
| 沸点 | 84-86ºC17 mm Hg(lit.) |
| 熔点 | 181ºC |
| 分子式 | C10H16O |
| 分子量 | 152.23300 |
| 闪点 | 148 °F |
| 精确质量 | 152.12000 |
| PSA | 17.07000 |
| LogP | 2.25760 |
| 外观性状 | 无色或近乎于无色液体带有一种像薄荷醇的气味 |
| 折射率 | n20/D 1.450 |
侧柏(Platycladus orientalis(L.) Franco)属于绿乔木,柏科植物,别名扁柏和片柏等,是我国的特产[5]。侧柏寿命很长,常有百年和数百年以上的古树。《本草纲目》将柏定义为“香木类上品”,《史记》更将柏定为“百木之长”。长在岩石或悬崖上的侧柏(俗称崖柏),由于营养贫瘠和环境恶劣,生长极其缓慢,上百年而常不盈尺,民间亦有“千年松、万年柏”之说,主要分布在太行山脉、秦岭山脉和大巴山脉等,其树根、树干具有木质密度高和油性大的特点,并有着醇厚的柏木香味。
据科学研究测试,侧柏木所提取出挥发性的精油,在工业上广泛用于木香型辛香型等的香精中和其他产品的增香剂,且具有排毒解毒、宁神舒筋和镇痛抗菌等作用。据研究,侧柏精油主要成分柏木脑(雪松醇)有活化作用,可作为血小板的活化因子(PAF)受体的拮抗剂,在炎症反应中,人类的呼吸系统和心血管疾病等中发挥重要作用;其次,其还有镇静作用和解痉挛活性和调节心血管系统的作用[6]。最新研究还发现,雪松醇还有抗肿瘤活性抗癌的作用[7]。此外,侧柏精油还具较强的抗蚁抗虫作用[8]。由于侧柏精油中还含有少量的没药醇,其具有多种生物活性,并且可以跟其它抗生素产生协同抗炎消炎作用。

精油的传统生产工艺,一般采用的是加压(压榨)提取法或溶剂提取法[9]。但这些方法提取精油都需要花费较长的提取时间,且精油提取率不高、纯度低,不符合现在工业生产的要求。超临界流体萃取法(SCFE)是近30多年出现的一种新型的萃取分离技术,是以超临界流体为溶剂,从固体或液体中萃取可溶组分的分离操作技术。其中,超临界流体具有良好选择性,其低粘度、高扩散系数等优点,可以有效提高物质交换效率,超临界萃取技术也是符合绿色化学原则的新型萃取技术[10]。其中,CO2作为一种理想的超临界流体(无毒性、不可燃性和经济性),已经广泛利用于超临界流体萃取植物精油的研究和生产中[11,12]。侧柏精油拥有独特的芳香味,并具有抗菌消炎、舒筋宁神和镇静阵痛等功效作用,可广泛利用于各类香精香料、保健食品以及功效化妆品的研究开发中。侧柏木的陈化时间对其精油的风味、含量、组成和功能等方面均具有重要影响,树龄越老陈化时间越长的侧柏木提取出的侧柏精油得率更高、木香更纯正浓郁、有效成分含量和功效也越高,可开发和利用的价值也越高,应是我们今后研究和开发的重点。
侧柏酮的合成
1、六步全合成α-侧柏酮和d6-α-侧柏酮,容易获得同位素标记的代谢物
欧盟再次允许生产含有侧柏酮的产品,但已施加了最大限度的限制为了确保准确定量,评估这些产品是否满足要求,以及为了更好地检测微量的α-侧柏酮及其主要代谢物,需要获得同位素标记的衍生物。尽管Semmler在1900年就阐明了双环单萜的结构,到目前为止,只有一个全合成的报道。Oppolzer等人利用一种温和的钯催化环化策略,从商业上可得的材料经过12个步骤制备了对映体富集的α-侧柏酮。然而,这种方法不允许简单地引入低廉的同位素标记。因此,Konrad Tiefenbacher等开发并描述了一种新颖的六步法获得α-侧柏酮,该方法可以从便宜的d6-丙酮中引入同位素标记。随后合成的d6-侧柏酮 1b也衍生化成最重要的代谢物3b、4b和5b。我们的合成策略是基于醇6a/6b的后期氧化(方案1),然后在位置C4进行区域选择性和非对称选择性甲基化。这种方法似乎很有吸引力,因为醇6a/6b可以通过西蒙斯-史密斯环丙烷直接从环戊烯醇7a/7b中获得环戊烯醇7a/7b可追溯到已知的由环戊二烯和丙酮合成的二甲基富烯8a和8b。因此,便宜的d6-丙酮可以作为同位素标记的来源。[13]
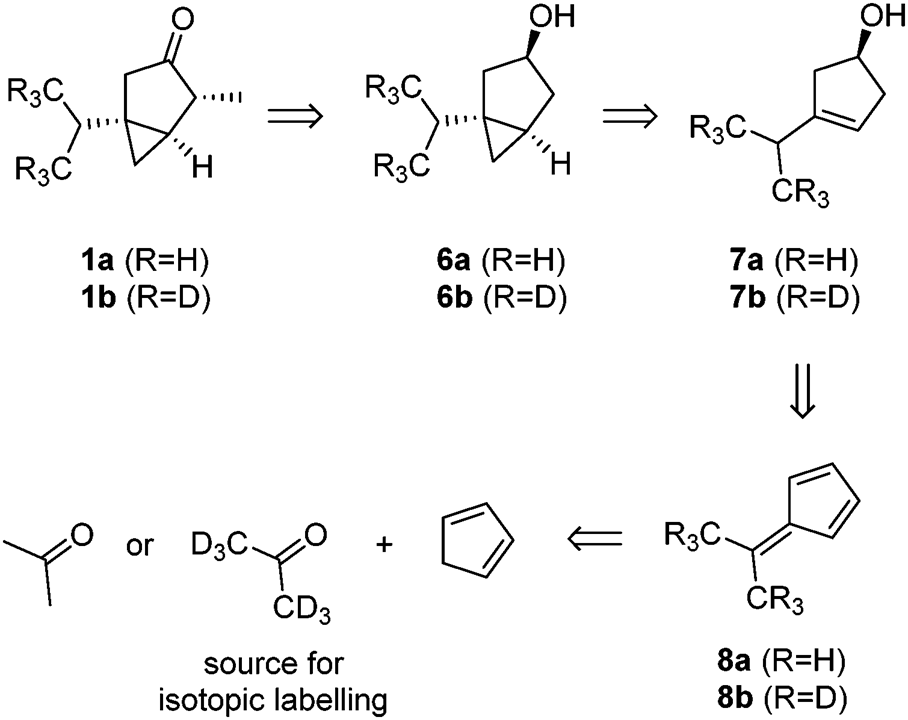
侧柏酮 1a/1b的合成 [13]
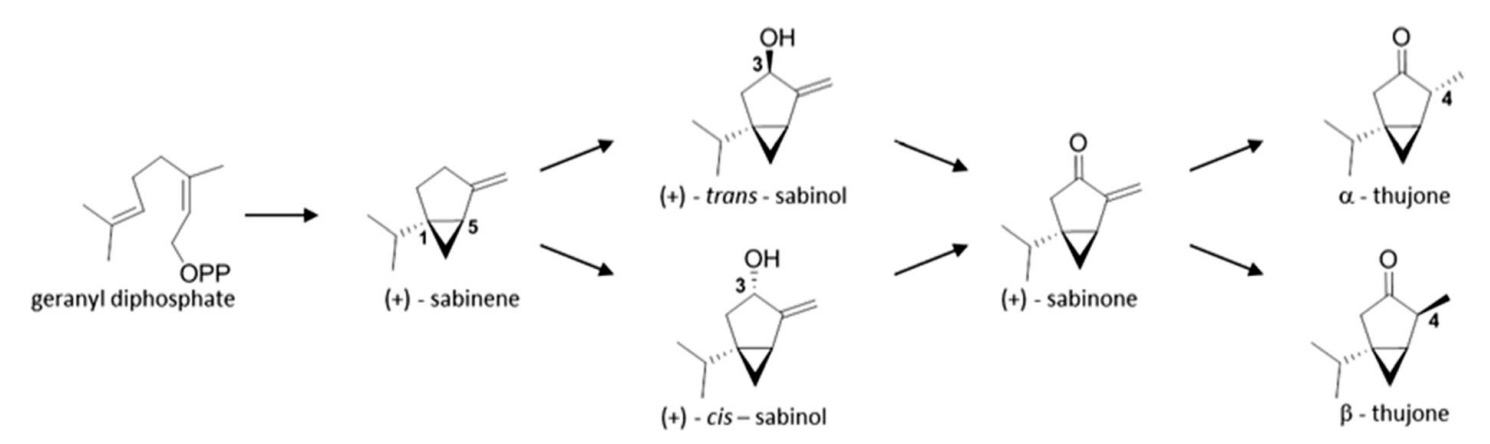
2、在北美乔柏中提出的a-和b-侧柏酮的生物合成
这一途径中的第一个单萜类化合物是桧烯,它的形成是由桧烯合成酶(SS)催化的。桧烯已被证明是苦艾、艾菊和药用鼠尾草(Karp和Croteau,1982年)中侧柏酮的前体。这种酶被认为是鼠尾草化学类型进化的一个 "热点"(Grausgruber-Gro¨ger等人,2012年)。在北美乔柏的桧烯合成酶应该是由一个单一的基因组位点调节(Foster等人, 2013)。后面的作者提议将其作为育种中标记辅助选择的候选者,因为它作为侧柏酮的前体具有基本的意义。虽然来自GPP前体的其他单萜的生物合成经常受到转录控制(Schmiderer等人,2010年;Xie等人,2008年),但在鼠尾草(S. officinalis)中,无法发现mRNA水平与桧烯最终产品之间的直接关联,这反映了更复杂的遗传/代谢组调节(Grausgruber-Gro¨ger等人,2012)。从桧烯出发,通过三个连续的步骤形成了侧柏酮(下图)。下一个生物合成步骤是,在裸子植物北美乔柏(Gesell等人,2015年)从桧烯到(+)-反式-香桧醇或在被子植物药用鼠尾草从桧烯到(-)-顺式-香桧醇(Karp和Croteau,1982年)。Gesell等人(2015年)确定CYP750B1和CYP76AA25是催化(+)-桧烯羟化为反式香桧-3-醇的酶。第一种酶的作用是至关重要的,它似乎具有强烈的底物特异性,而CYP76AA25具有更广泛的底物谱,其转录谱与侧柏酮的积累没有很好的相关性(Gesell等人,2015)。早些时候,Karp和Croteau(1982年)认为(-)-顺式-香桧醇是鼠尾草中同一途径的中间体;然而,不知道艾蒿和其他物种的合成是通过反式还是顺式香桧醇进行的。在一些论文中,反式香桧醇的存在已经被证明在苦艾精油中(Blagojevic´等人,2006年;Judzentiene和Budiene,2010年);因此,它可能是这里的一个中间物的候选产物。在香桧醇之后,只有桧酮的(+)异构体被提到是侧柏酮生物合成的下一个中间体。它的形成是一个依赖NADPH和氧基因的羟基化过程。根据对鼠尾草和艾菊的调查,Dehal和Croteau(1987)认为,脱羟酶对 "底物组 "表现出相当程度的特异性。从桧酮开始,侧柏酮的形成是一种依赖NADPH的立体选择性还原。这种转化的相应酶和不同的侧柏酮异构体(α-或β-侧柏酮)的形成,也还没有得到澄清。根据参考文献,一些物种只积累其中一种,而在其他植物中可能存在两种异构体。[14]
侧柏酮的药理活性
1、含有鼠尾草和艾草的食品和药品中的侧柏酮的风险评估--有证据表明需要进行监管改革?
侧柏酮是一种天然物质,通常用于食品和饮料中,存在于艾草和鼠尾草,以及草药中。目前对食品中的侧柏酮的限制是基于20世纪60年代的短期动物研究,这些研究为基于阈值的机制提供了证据,但只允许根据无观测效应水平(NOEL)推导出可接受日摄入量(ADI)的初步数值。虽然2008年欧盟关于香原料的法规取消了对侧柏酮的食品使用的管制,但欧洲药品管理局在2009年对该物质进行了限制。本研究使用基准剂量(BMD)方法而不是NOEL来重新评估现有证据,并首次纳入了国家毒理学计划(NTP)的长期慢性毒性研究的数据。NTP的数据提供了与之前短期研究类似的结果。利用剂量反应模型,计算出雄性大鼠痉挛性发作的基准反应的BMDL下限(BMDL10)为11毫克/千克体重/天。在此基础上,我们提出了0.11毫克/千克体重/天的每日允许摄入量,即使是高含量的含侧柏酮食品(包括苦艾酒)的消费者也无法达到这一指标。虽然关于药物中的侧柏酮暴露的数据较少,但我们估计需要喝2至20杯艾草或鼠尾草茶才能达到这一ADI值,并认为这些草药的短期药用也可以被视为安全。总之,证据并不表明需要修改法规,而是确认目前的限制对消费者有足够的保护。[15]
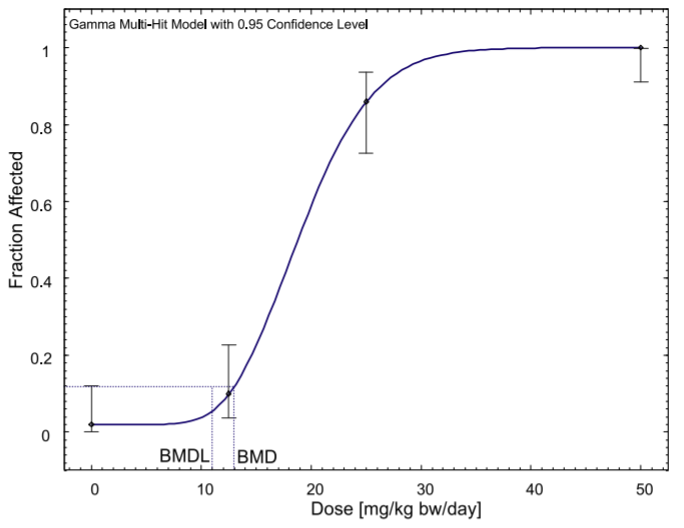
BMD模型对雄性B6C3F1大鼠痉挛发作的长期慢性研究。原始数据来自NTP(2009)。
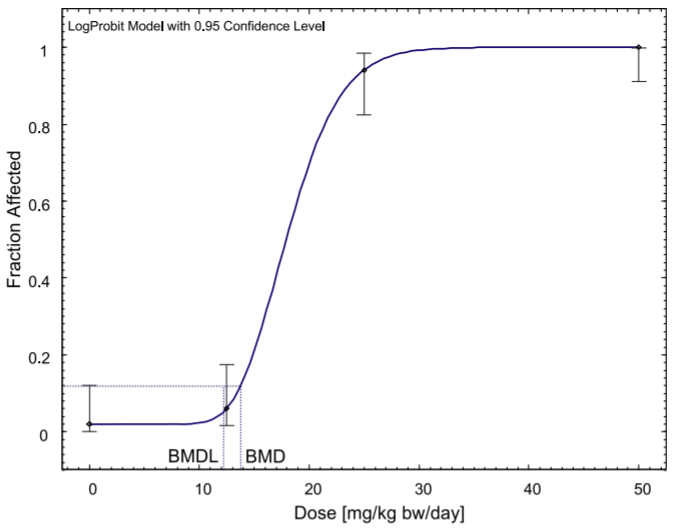
在一项对雌性B6C3F1大鼠的长期慢性研究中,建立BMD模型治疗痉挛发作。原始数据来自NTP(2009)。
2、α,β-thujone通过代谢重编程和半胱氨酸蛋白水解酶依赖性凋亡在卵巢癌细胞中的治疗潜力
α,β - 侧柏酮通过半胱氨酸蛋白水解酶(caspase)依赖性凋亡降低卵巢癌细胞增殖并促进细胞死亡。此外,α,β - 侧柏酮诱导线粒体去极化和钙超载,导致代谢稳态的破坏。α,β - 侧柏酮 -触发的细胞凋亡与内质网应激有关,内质网应激调节蛋白酶体活性,促进细胞死亡信号。最后,α,β - 侧柏酮在ES2和OV90卵巢癌细胞系中与抗癌药物顺铂协同作用,并通过致敏和改变细胞死亡模式提高其疗效。综上所述,Lee和Park的研究结果表明,α,β - 侧柏酮,无论是单独使用还是联合使用,都可能有助于克服卵巢癌治疗中使用的铂基化疗药物的耐药性。[16]
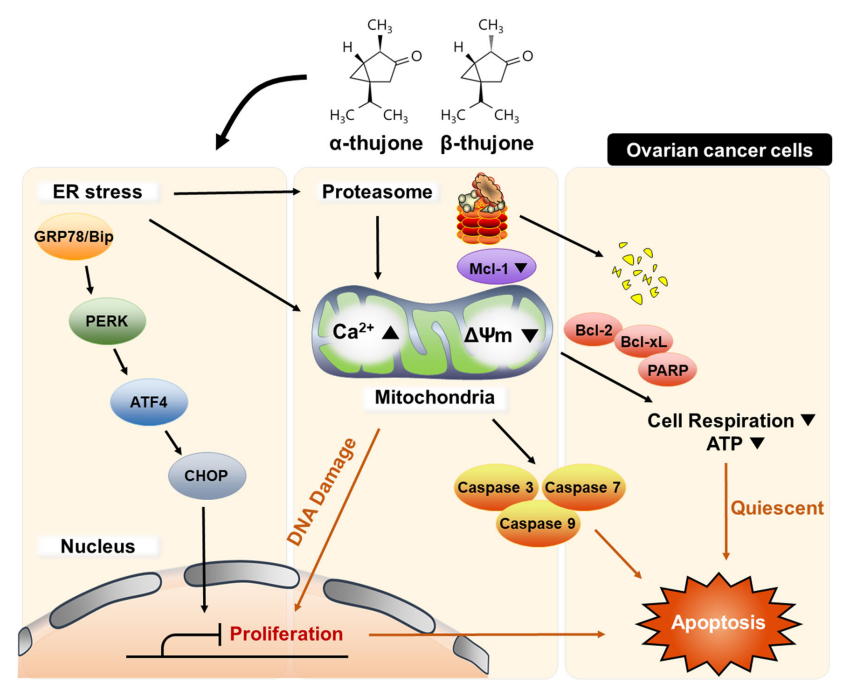
α,β - 侧柏酮 -诱导的卵巢癌细胞的抗癌活性示意图。三磷酸腺苷、三磷酸腺苷;ER,内质网[16]
3、体外人肝制剂中α-侧柏酮的代谢研究
本研究旨在表征α-侧柏酮在人肝脏制剂中的代谢特征,并确定细胞色素P450 (CYP)和其他可能催化α-侧柏酮生物转化的酶的作用。采用液相色谱-质谱(LC-MS)方法测定α-侧柏酮和四种潜在代谢物,证明人肝微粒体产生两种主要的(7-和4-羟基侧柏酮)代谢物和两种较小的(2-羟基侧柏酮和香芹酚)代谢物。在人肝脏匀浆中检测到谷胱甘肽和半胱氨酸偶联物,但未定量。未检测到葡萄糖醛酸或硫酸盐缀合物。主要的羟基化作用占α-侧柏酮微粒体主要代谢的90%以上。用CYP重组酶对α-侧柏酮代谢进行筛选,发现CYP2A6主要参与7-和4-羟基化反应,而CYP3A4和CYP2B6参与的程度较低,CYP3A4和CYP2B6催化的2-羟基化反应较少。根据不同重组CYP酶的内在效率和这些酶在人肝微粒体中的平均丰度,计算出CYP2A6是人肝微粒体中最活跃的酶,平均负责70-80%的代谢。抑制筛选结果显示,α-侧柏酮对CYP2A6和CYP2B6均有抑制作用,50%的抑制浓度分别为15.4µM和17.5µM。[17]
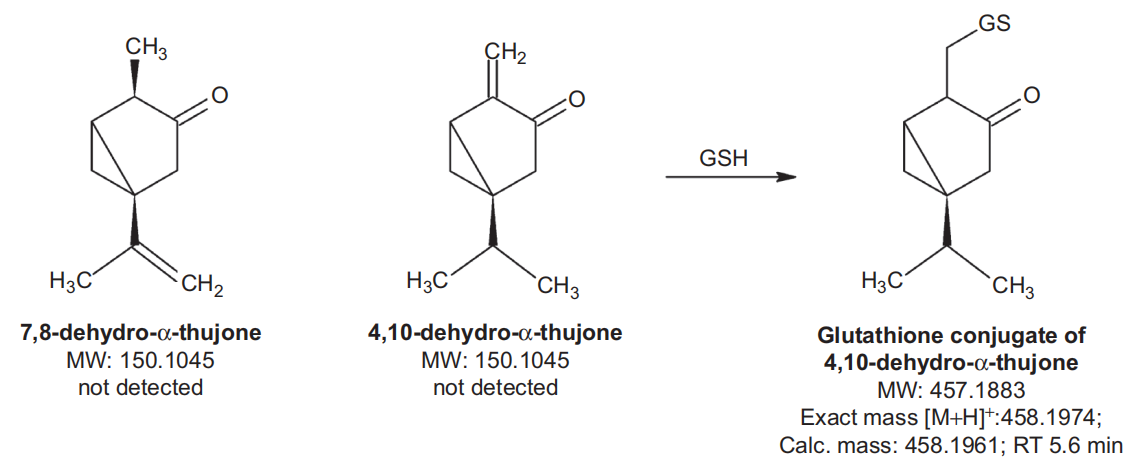
可能的α-侧柏酮代谢产物的结构。说明了代谢产物的名称、分子量(MW)、确切质量和保留时间(RT)[17]
4、苦艾酒:侧柏酮影响下的注意力表现和情绪
这项研究的目的是确定苦艾酒对注意力表现和情绪的影响是否不同于那些只含有酒精的饮料。引起苦艾酒毒性的成分被认为是侧柏酮。共有25名健康受试者参与了这项研究。我们使用了注意力表现测试和两份不同情绪维度的问卷。他们提供了三杯酒,酒精含量相同,但侧柏酮的含量不同。本研究结果表明,同时给药含有高浓度侧柏酮的酒精对注意力表现有负面影响。在此条件下,被试倾向于将注意力集中于中心注意域的信号,而忽略外围注意域的信号;外周注意域正确反应次数显著减少,反应时间和“误报”反应次数显著增加。这种影响在第一次测量时最为显著。当受试者在酒精的影响下或同时被给予酒精和低浓度的侧柏酮时,这些效应没有被观察到。情绪状态维度的评估显示酒精的抗焦虑作用被高的侧柏酮浓度暂时抵消。由于它们显然与酒精的作用相反,这里观察到的反应可以用侧柏酮对γ -氨基丁酸受体的拮抗作用来解释。在其他的情绪状态维度上也观察到了类似的变化。[18]
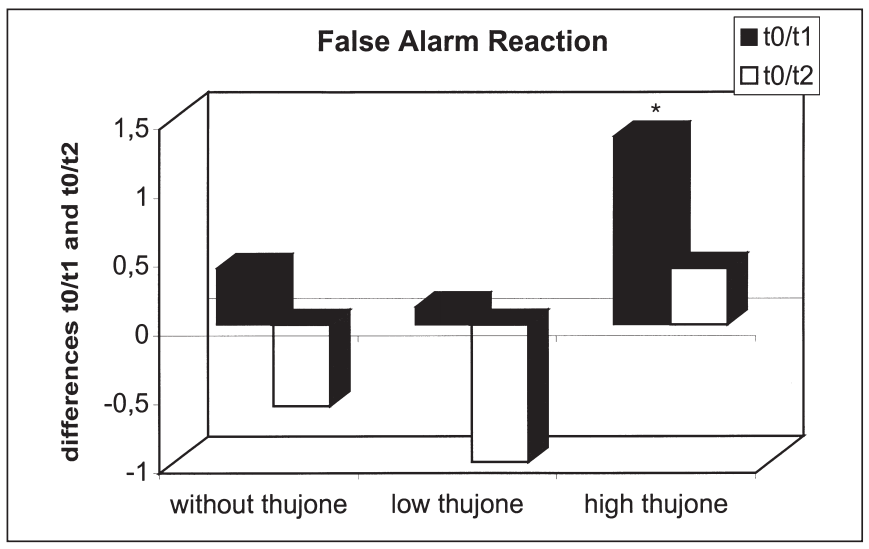
三种治疗方法T0-T1 (T0-T2)误报反应差异比较:酒精检测阴性(T0)、酒精摄入后30分钟(T1)、酒精摄入后90分钟(T2)(*表示差异有统计学意义)
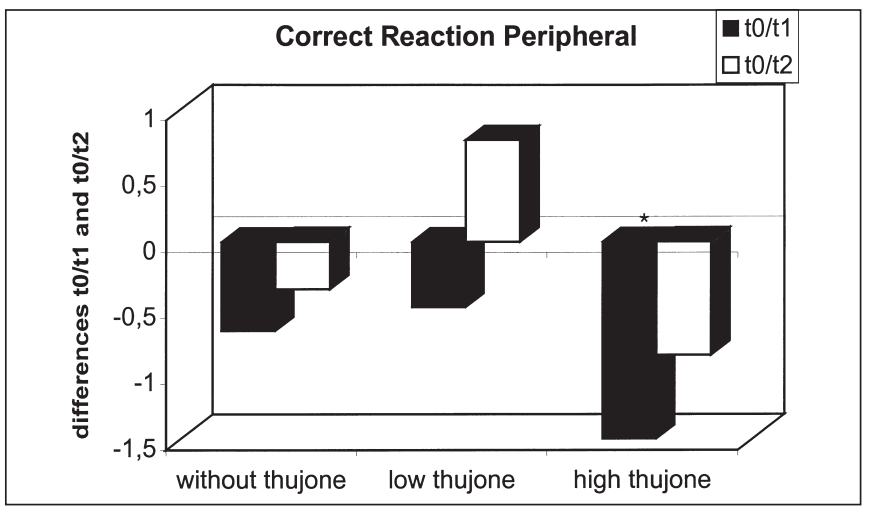
3个治疗组T0-T1 (T0-T2)外周正确反应差异比较:酒精检测阴性(T0)、酒精摄入后30分钟(T1)、酒精摄入后90分钟(T2)(*表示差异有统计学意义)
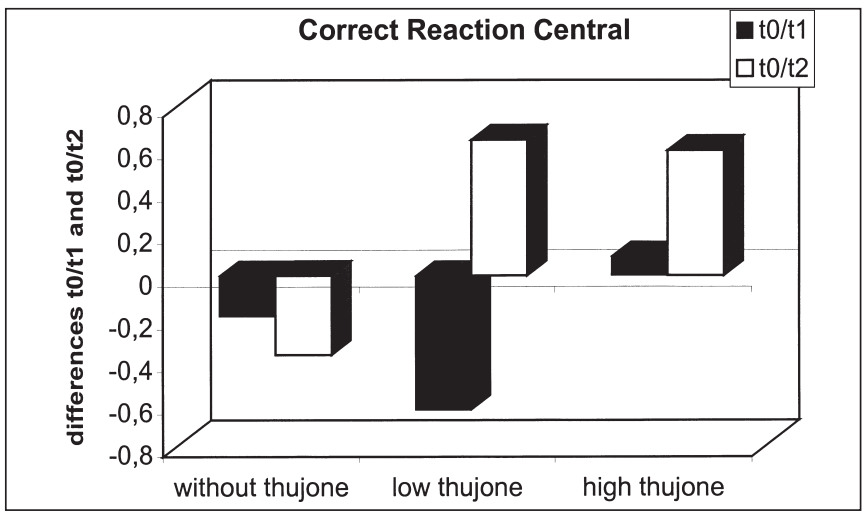
三种治疗方法在T0-T1 (T0-T2)中枢正确反应的差异比较:酒精阴性(T0)、酒精摄入后30分钟(T1)、酒精摄入后90分钟(T2)
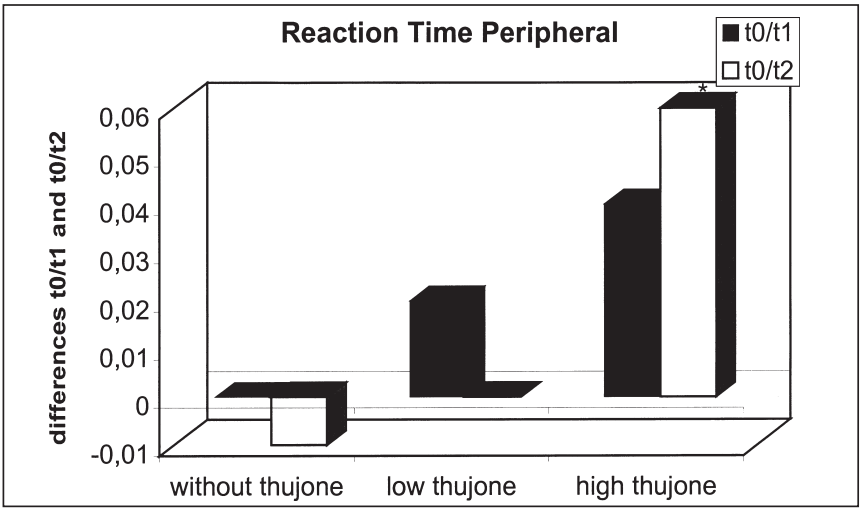
比较三种处理的T0- t1 (T0- t2)外周反应时间的差异:酒精检测阴性(T0), 30
饮酒后分钟(T1)、饮酒后90分钟(T2)(*表示差异有统计学意义)
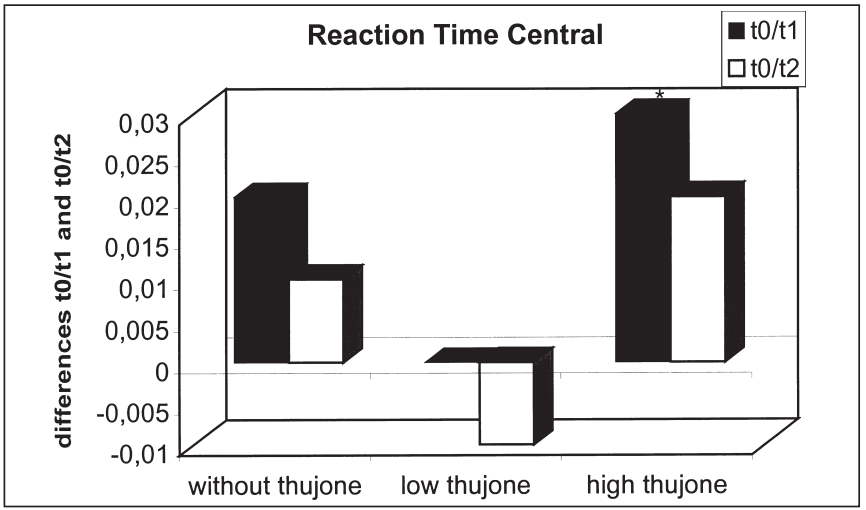
三种治疗方法T0-T1 (T0-T2)中枢反应时间差异比较:酒精阴性(T0)、酒精摄入后30分钟(T1)、酒精摄入后90分钟(T2)(*表示差异有统计学意义)
参考文献:
[1] https://zoelogic.pixnet.net/blog/post/47723454.
[2] https://zh.wikipedia.org/wiki/%E4%BE%A7%E6%9F%8F%E9%85%AE
[3]CN201811394406.7一种负氧离子纳米净醛喷剂
[4]CN201610417280.5一种基于香料阈值的木香香型烟用香精及其调配方法
[5] 回瑞华,侯冬岩,刘晓媛,等.不同方法提取侧柏叶中挥发性成分的气相色谱-质谱分析[J].质谱学报,2006,27(4):226-231
[6] 张岩,曲凡志,赵余庆.柏木醇的药理作用研究进展[J].沈阳药科大学学报,2014,31(7):584-588
[7] 蒋继宏,李晓储,高雪芹,等.侧柏挥发油成分及抗肿瘤活性的研究[J].林业科学研究,2006,19(3):311-315
[8] 黄洛华,龙玲,陆熙娴,等.侧柏枝叶精油的化学组成与抗蚁性[J].林业科学研究,2001,14(4):416-420
[9] Kátia Andressa Santosa, Reinaldo Aparecido Bariccatti, Lúcio Cardozo-Filho, et al. Extraction of crambe seed oil using subcritical propane: Kinetics, characterization and modeling [J]. The Journal of Supercritical Fluids, 2015, 104: 54-61
[10] S M García-Abarrio, L Martin, J Burillo, et al. Supercritical fluid extraction of volatile oil from Lippia alba (Mill.) cultivated in Aragón (Spain) [J]. The Journal of Supercritical Fluids, 2014, 94: 206-211
[11] Edgar Uquiche, Natalia Cirano, Sonia Millao. Supercritical fluid extraction of essential oil from Leptocarpha rivularisusing CO2[J]. Industrial Crops and Products, 2015, 77: 307-314
[12] E Arranz, L Jaime, M C López de las Hazas, et al. Supercritical fluid extraction as an alternative process to obtain essential oils with anti-inflammatory properties from marjoram and sweet basil [J]. Industrial Crops and Products, 2015, 67: 121-129.
[13] Irene Thamm a, Johannes Richers b, Michael Rychlik a and Konrad Tiefenbacher. A six-step total synthesis of α-thujone and d6-α-thujone, enabling facile access to isotopically labelled metabolites. Chem. Commun., 2016, 52, 11701-11703. DOI: 10.1039/C6CC05376A
[14] Németh, Éva & Thi Huong, Nguyen. (2020). Thujone, a widely debated volatile compound: What do we know about it?. Phytochemistry Reviews. 19. 10.1007/s11101-020-09671-y.
[15] Dirk W. Lachenmeier; Michael Uebelacker (2010). Risk assessment of thujone in foods and medicines containing sage and wormwood – Evidence for a need of regulatory changes?. Regulatory Toxicology and Pharmacology, 58(3), 437–443. doi:10.1016/j.yrtph.2010.08.012
[16] Lee, Jin-Young; Park, Hahyun; Lim, Whasun; Song, Gwonhwa (2020). Therapeutic potential of α,β thujone through metabolic reprogramming and caspase-dependent apoptosis in ovarian cancer cells. Journal of Cellular Physiology, 1-14. doi:10.1002/jcp.30086
[17] Abass, Khaled & Reponen, Petri & Mattila, Sampo & Pelkonen, Olavi. (2010). Metabolism of α-thujone in human hepatic preparations in vitro. Xenobiotica; the fate of foreign compounds in biological systems. 41. 101-11. 10.3109/00498254.2010.528066.
[18] Dettling, A & Graß, Hildegard & Schuff, A & Skopp, Gisela & Strohbeck-Kühner, Peter & Haffner, H. (2004). Absinthe: Attention performance and mood under the influence of thujone. Journal of studies on alcohol. 65. 573-81. 10.15288/jsa.2004.65.573.

在清晨淋浴后那抹清新柑橘香中,在洗衣晾晒后衣物飘散的淡雅花香里,日化香精悄无声息地塑造着我们的日常生活体验。
2026-01-03香精公司
神经科学研究表明,气味是人类最古老的感官之一,与记忆和情绪的联系最为直接。当特定气味与品牌建立稳定关联时,便形成了难以复制的竞争优势。
2025-12-27香精公司
香精,这个曾经仅仅作为产品功能附加值的成分,如今已演变为品牌叙事中的核心角色,成为连接产品功能与消费者情感的关键桥梁。
2025-12-11香精公司
从沐浴露的清新前调到香水的复杂尾韵,香精不再仅仅是产品的附加属性,而是化身为品牌与消费者建立情感连接的桥梁,成为驱动购买决策的新引擎。
2025-11-29香精公司
本文将深入剖析日化香精行业的市场规模与核心增长动力,探寻这片“香”场未来的机遇所在。
2025-11-15香精厂家