2022年03月11日淘美妆商友会浏览量:0
今天(3月10日),国家药监局官网发布了关于化妆品监督管理常见问题的解答,针对哪些化妆品需要做功效评价、化妆品原料安全信息填报、化妆品留样的具体数量要求等,做出了明确指示。
>>>国家药监局官网发布最新解答
不少行业人士表示,药监局这次与企业实操相关的解答,释放出了给企业“松绑”的信号。
1
很多化妆品不需要做人体功效评价
还支持修改产品名称
自化妆品新规实施以来,化妆品功效宣称评价一直是压在企业身上的一座“大山”,化妆品功效检测机构鱼龙混杂,化妆品检测费用高、周期长,有相当一部分企业不堪重负,不得已选择关厂、关店,退出市场。
但如何正确认识化妆品功效宣称评价?国家药监局在本次解答中表示,“对上市化妆品中占大多数的能够通过视觉、嗅觉等感官直接识别的(如清洁、卸妆、美容修饰、芳香、爽身、染发、烫发、发色护理、脱毛、除臭和辅助剃须剃毛或通过简单物理遮盖、附着、摩擦等方式发生效果等)宣称,均免予功效评价”。
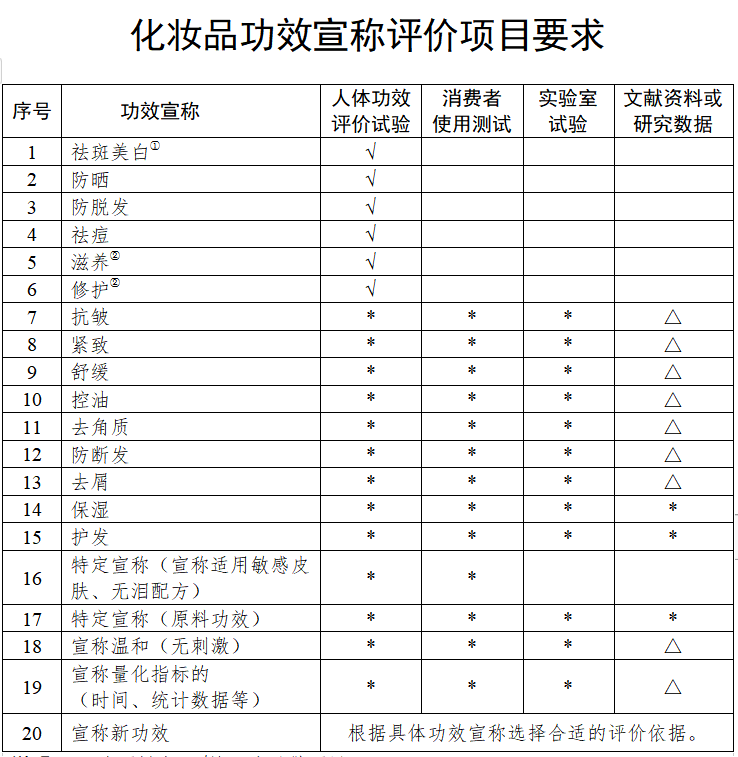
荃智美肤生物科技研究院研发总监张太军表示,这意味着,消费者可以自己判断的产品,就可以通过感官描述,用感性一点的词汇做宣称,就能免于做功效评价报告。不过,这个感性宣称的“度”,要把握好。
根据《化妆品功效宣称评价规范》的要求,在2021年5月1日前已经注册备案的化妆品,化妆品注册人、备案人应当按照过渡期政策规定,在2023年5月1日前上传相关产品功效宣称依据的摘要。
不过,国家药监局在此次解答中指出,如果相关注册人、备案人按照要求对相关产品进行功效宣称评价后,评价结果不能支持其产品名称或标签涉及的功效宣称内容的,可在过渡期届满前提出变更申请,可以“根据产品实际属性对产品的分类编码进行调整,同时对产品名称或标签相关内容进行修改,使之符合法规要求。”
对此,恩特科技合伙人方维亚表示,这意味着,“虽然你以前注册备案的时候,产品宣传了某功效,比如修护,但你现在发现做不到,那你就可以在本来要完成功效摘要上传的截止日期前,变更产品名称或标签,不宣传修护。”
要知道,此前,化妆品注册备案系统并不支持化妆品产品名称变更,后续更名的功能很可能要开放。“允许企业对过往名称进行变更,解决了企业的实际难点。”方维亚如是说到。
对于较高的功效宣称评价检测费用,广州汇佳玲生物科技有限公司总工程师廖霖峰表示,“化妆品是由各种原料组成的,如果每一种原料的安全功效评测已经过关,配方用量加到起效量以上,又不超过限用量,化妆品配方除皂基洁面膏外,很少化学反应,都物理混合。这样企业产品安全评价、功效宣称应该可以引用原料文献资料,不仅可以省下天价检测费用,也可以省下大量的人力物力与社会资源。”
2
原料报送码不再是备案必选项
能提交原料安全信息即可
在此前与化妆品生产企业、品牌方沟通交流时,不少企业反应,部分主业不是经营化妆品原料的原料商,对于填报化妆品原料报送码的配合意愿不强。
莹特丽集团中国区总裁王邑华就曾对淘美妆商友会表示,很多供应商无法及时提供原料的安全信息资料,“有时还会遇到我们收到的这项资料,与原料商提交的原料报送码信息不匹配的情况,大大增加了沟通成本和人力成本。”
为解决这一实际问题,本次国家药监局在解答中表示,化妆品注册人、备案人可仅填报原料生产商提供的原料报送码由平台进行关联,无需重复填报详细的原料安全信息,提高化妆品注册备案工作效率。

“对尚无原料报送码的,并不影响化妆品注册备案工作,化妆品注册人、备案人可根据原料生产商出具的原料安全信息文件,在化妆品注册备案平台填报原料安全相关信息。”
对此,方维亚表示,过往很多原料商都处在适应填报原料报送码的过程中,“现在只需上传原料安全信息文件,相关企业不用再被动的等原料商去完成工作,能帮助加快化妆品备案进程。”
3
明确化妆品留样的具体数量
进口化妆品同批次最少只需留样一次
对化妆品留样的要求,在《化妆品生产经营监督管理办法》《化妆品注册备案资料管理规定》《化妆品生产质量管理规范》中都有体现。
但此前,上述法规并没有对不同品类、不同批次产品的留样数量做出明确规定,这很容易导致企业无法操作,各地监管部门执法也没有统一标准。
在本次解答中,国家药监局梳理了市场上销售的常见产品的留样数量,给出了化妆品注册人、备案人产品留样数量参考表。
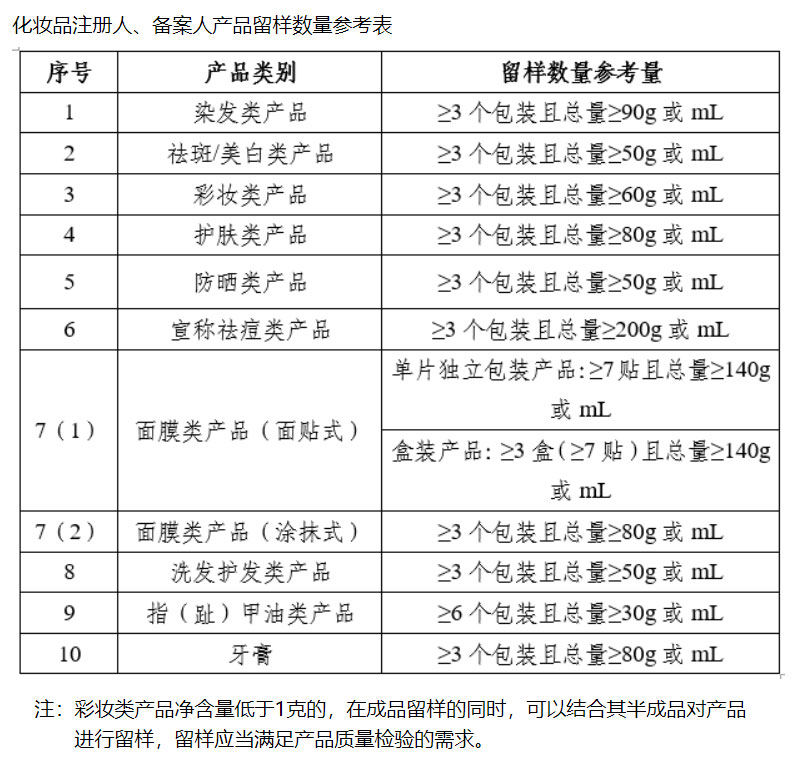
>>>化妆品注册人、备案人产品留样数量参考表
对于进口品留样,相关规定曾明确指出2022年1月1日后,境外化妆品注册人、备案人应当对其进口中国的每批次产品进行留样,样品及记录交由境内责任人保存。
那么,到底怎么留样合适?国家药监局在解答中明确表示,“分多次进口同一生产批次产品的,应当至少于首次进口时留样一次。”
方维亚表示,这一规定明确后,能很好的降低企业负担。“同一批次留样一次就可以代表这个批次产品的整体情况,如果还要每次进口留样,也浪费产品和空间。”
对于留样场所,依据《化妆品生产质量管理规范》,委托生产的化妆品注册人、备案人应当在其住所或者主要经营场所留样,也可以在其住所或者主要经营场所所在地的其他经营场所留样。
国家药监局在解答中明确指出,对“其住所或者主要经营场所所在地”中“所在地”的理解,通常认定为不超出同一地级市或者同一直辖市的行政区域内。境内责任人保存留样的,其留样地点的选择应当参照上述规定执行。留样地点的选择,能满足法律法规的规定和标签标示的产品贮存要求即可。
方维亚表示,整体来看,“这次的解答明确了很多实操细节,更有实操意义。”
张太军进一步指出,这次国家药监局发布的解答通知,“核心表达的是鼓励更加灵活务实的落实新规。避免死板,甚至对法规要求进行加码,影响市场效率。”
“后续在新规实施过程中,相应监管部门也会更多听取民意,听到企业的心声,为企业发展减负。”某行业人士表示,这将更利于行业快速、健康发展。

1、有一个制药的研发直接把粉末香精弄一点放嘴里,直说苦,说你的香精不好,我哭笑不得。2、把液体香精弄一点在手上拼命搓,然后闻。3、直接鼻子对着香精样品瓶口闻,说...
2023-02-11厦门香精生产厂家
对于香精公司来说,避免不了回答的三个留香问题:1、香精公司保持留香的方法一般是添加持久留香的原料,那么这个添加留香的原料是否对香精有限制?如果有限制的话,那么需...
2023-02-08香精公司
向来质感高、充满品牌内涵的爱马仕香水今年灵感来自中国,创作性地推出“李氏花园” 香水,这是爱马仕御用调香师吉恩(Jean-Claude Ellena,JCE)的...
2022-12-27香水香精厂家
1、莫宁股份2023年食品和饮料预测根据该报告,茶正在扩展到多个日常时段,其中Boba tea(如图所示)、奶茶、玛塔和康普茶一直是趋势。在过去的几周里,我们看...
2022-12-10中外香料香精第一资讯
造纸术是我国古代科学技术“四大发明”之一,到了现代,纸已经不仅仅是用于书写、印刷文字,而成了人们日常生活不可或缺的“伴侣”——吃饭时要用餐巾纸,餐桌上要铺桌纸,...
2022-12-02香精的生产厂家