2022年03月29日中外香料香精第一资讯浏览量:0
覆盆子酮,又称树莓酮,是一种天然酚类化合物,是红树莓的主要芳香化合物。
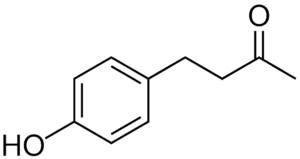
覆盆子酮的结构式
Preferred IUPAC name:4-(4-Hydroxyphenyl)butan-2-one
Other names: p-Hydroxybenzyl acetone; 4-(p-Hydroxyphenyl)-2-butanone; Frambinone; Oxyphenylon; Rheosmin; Rasketone
来源
覆盆子酮存在于多种水果中,包括树莓、蔓越莓和黑莓。它是由香豆酰辅酶a生物合成的。它可以从果实中提取,每公斤树莓的产量约为1-4毫克。

树莓(Raspberry)
制备
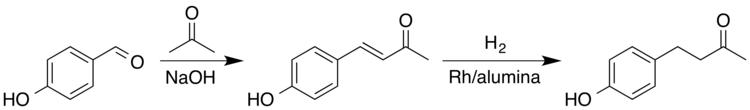
由于覆盆子酮的天然丰度很低,工业上通过多种方法从化学中间体中制备覆盆子酮。其中一种方法是通过交叉醛醇缩合,然后催化氢化。首先,丙酮与4-羟基苯甲醛缩合形成α、β不饱和酮。然后烯烃部分被还原成烷烃。这种两步法生产覆盆子酮的产量为99%。硼化镍是一种较便宜的加氢催化剂,它对烯酮双键的加氢也表现出较高的选择性。
应用
覆盆子酮有时用于香水、化妆品和食品添加剂,以增加水果味。它是食品工业中使用的最昂贵的天然香料成分之一。这种天然化合物的价格高达每公斤2万美元。合成覆盆子酮更便宜,估计每磅几美元到天然产品成本的五分之一不等。虽然含有这种化合物的产品被用于减肥,但没有临床证据表明这种效果在人类身上可以显现。
安全性
人们对覆盆子酮补充剂的长期安全性知之甚少,尤其是在人类身上做的研究很少。因为它在化学上与兴奋剂辛弗林有关,所以它的安全性存在一些问题。毒理学模型表明潜在的心脏毒性作用,以及对生殖和发育的影响。此外,在许多含有覆盆子酮的膳食补充剂中,制造商添加了其他成分,如咖啡因,可能有不安全的影响。1965年,美国食品和药物管理局将用于调味食品的少量覆盆子酮归类为公认的安全(GRAS)。
覆盆子酮的生物合成
1、工程大肠杆菌共表达生姜酮合成酶和葡萄糖脱氢酶高效合成覆盆子酮 [1]
覆盆子酮(RK)是树莓果实的主要芳香化合物,在化妆品、食品和医药等领域有着广泛的应用。在本研究中,我们通过使用全细胞生物催化剂催化还原对羟基苄叉丙酮来生物合成RK。在大肠杆菌中表达芽孢霉的还原酶RiRZS1和嗜酸热浆菌的葡萄糖脱氢酶SyGDH,再生NADPH进行全细胞催化反应。通过平衡两种酶在pRSFDuet-1中的共表达,我们获得了9.89 g/L的RK,转化率为98%,时空产率为4.94 g/(L·h)。最适条件为40℃,pH 5.5,底物与辅助底物的摩尔比为1:2.5。本研究结果为RK的生物合成提供了一种有前景的方法。
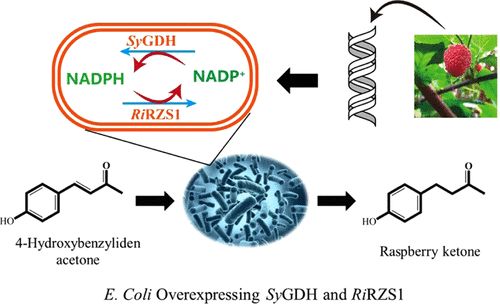
图1 工程大肠杆菌共表达生姜酮合成酶和葡萄糖脱氢酶高效合成覆盆子酮
2、通过几种不相关的植物细胞培养实现覆盆子酮的生物转化 [2]
生物转化,即利用生物系统在温和条件下对合成或天然化合物进行化学合成,是生产新的活性或高价值化合物的一种有吸引力的工具。植物细胞显示出巨大的生化潜力,能够通过酶的过程转化一系列物质,包括药物成分和工业副产品。植物细胞培养的使用为控制和优化生产过程提供了可能性,可应用于工业规模。覆盆子酮[4-(4-羟基苯基)丁烷-2-酮]是最有趣的天然香料化合物之一,因其高需求和巨大的市场价值。这种与工业相关的风味化合物的生物合成具有较好的表征,它包括3型聚酮合酶将4-香豆酰辅酶a和丙二酰辅酶a缩合成二酮,然后由NADPH依赖性还原酶催化还原。覆盆子酮已成功地利用不同的宿主和前体进行生物转化,建立了更有效和经济的过程。本实验研究了烟草中过表达RiZS1对覆盆子酮前体生物转化的影响。此外,研究了各种野生型植物细胞培养物以4-羟基亚苄基丙酮或桦木醇为底物进行覆盆子酮生物转化的能力。显然,植物细胞具有相当广泛分布的还原酶活性,能够利用廉价和易得的前体进行生物转化为覆盆子酮。
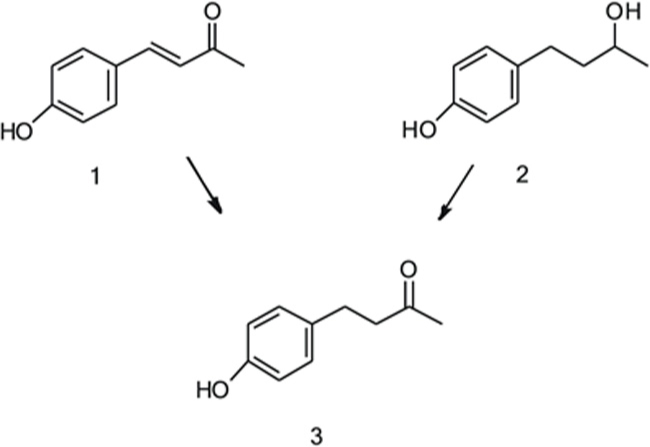
图2 4-羟基亚苄基丙酮(1)和桦木醇(2)转化树莓酮(3)
树莓衍生的前体化合物1在自然界并不丰富,但可以通过羟基苯甲醛和丙酮的缩合细菌培养产生。化合物2是一种从红豆杉(Taxus wallichiana)中分离得到的二级醇。在桦树皮、杜鹃、赤杨、枫树和冷杉中也发现了这种物质,主要以糖基化形式存在,称为白桦糖苷。白桦糖苷可以通过微生物β-葡萄糖苷酶转化为白桦黄素。化合物2转化为3已经被各种微生物细胞和颠茄毛根成功地实现。在Kosjek et al.(2003)的一项研究中,放线菌红球菌(actinomycete Rhodococcus)利用丙酮作为氢受体进行了从2到3的氧化反应。然而,当颠茄毛状根被加入底物2时,化合物3和白桦糖苷都可以在不需要额外的辅助基质的情况下形成。另一方面,Fujita et al.(1998)表明毛果槭(Acer nikoence)愈伤组织培养可以转化化合物3到2和它们的糖苷。有趣的是,3只存在于培养基中,而糖苷则存在于细胞内空间。作者认为,某种特定的醇脱氢酶(ADH)和糖基转移酶参与了这些反应。化合物1的生物转化通过各种微生物细胞完成,产生具有不同转化效率的覆盆子酮。他们观察到,随着孵化时间的延长,1到3的转化可以伴随2的生成。已知从1到3的反应是由一种依赖NADPH的酶催化的,这种酶是Koeduka等人(2011)从覆盆子(Rubus idaeus)中鉴定出来的。另一方面,从2到3的转化过程还没有被确定。事实上,Beekwilder等人(2007)表明,大肠杆菌在向表达亚苄基丙酮合成酶(BAS)的细胞注入p-香豆酸后,具有内源性还原酶活性,可将1转化为3。因此,这种转化所需的还原酶活性很可能在自然界中分布得相当广泛。在本研究中,我们介绍了与覆盆子酮相关的生物转化研究,研究对象是来自与覆盆子无关的植物的各种植物细胞培养。
3、高价值精细化学品覆盆子酮的高产“一锅法”生物合成 [3]
无细胞萃取物和基于纯化酶的系统为研究一系列化学物质的生物合成策略提供了一个有吸引力的解决方案。4-(4-羟基苯基)丁烷-2-酮,又称覆盆子酮,是树莓果实的主要香味成分,是食品和运动行业的天然添加剂。目前,自然形态的覆盆子酮的工业加工涉及到从产量为~ 1 - 4毫克每公斤的果实中进行化学提取。由于毒性,微生物生产只能提供高达5-100 mg /L的低产量。在此,我们报道了一种高效的无细胞策略,以探索一种合成酶途径,将L-酪氨酸或其前体4-(4-羟基苯基)-丁烯-2-酮转化为覆盆子酮,转化率高达100%。作为这一策略的一部分,廉价回收辅助因子是必要的。具体来说,该途径的最后一步酶是由覆盆子酮/姜酮合酶(RZS1)催化的,这是一种依赖于NADPH的双键还原酶。为了放松辅助因子对NADH(游离细胞生物合成的首选辅助因子)的特异性,我们鉴定了一种与NADH具有强烈活性的异构酶(G191D)。我们在“一锅”无细胞反应中实现了RZS1 G191D异构,以高产量(61 mg/L)生产覆盆子酮,这为传统微生物生产提供了一种替代途径。总之,我们的无细胞策略补充了对工程合成酶级联到工业相关的增值化学品的日益增长的兴趣。
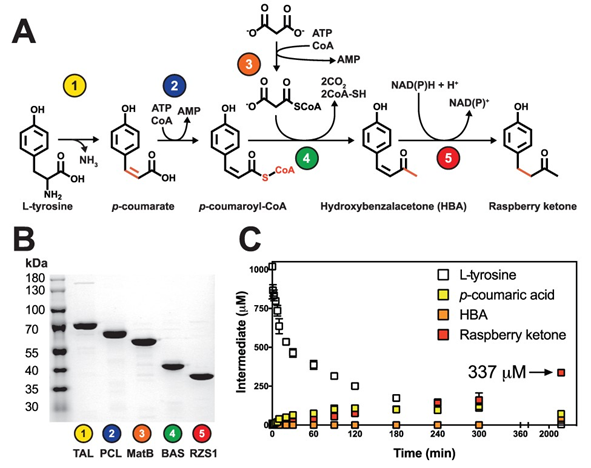
图3 覆盆子酮无细胞生物合成的模块。从L-酪氨酸到丙二酸合成覆盆子酮的合成途径。B.合成路径上酶的SDS-PAGE。2 μg酶纯化后,进行12% (v/v) SDS-PAGE和考马斯亮蓝染色分析。his6标记重组酶- r的大小。粘虫(glutinis TAL) (77.0 kDa)、拟南芥(A. thaliana PCL) (63.2 kDa)、沼泽沙鼠(R. palustris MatB) (56.6 kDa)、掌叶沙鼠(R. palmatum BAS) (44.4 kDa)、红沙鼠RZS1 (40.7 kDa)。C.用2.5 μM酶在标准条件下一锅法合成覆盆子酮。LC-MS测定的中间体包括L-酪氨酸(白框)、p-香豆酸酯(黄框)、HBA(橙框)和覆盆子酮(红框)。数据代表三次实验重复。
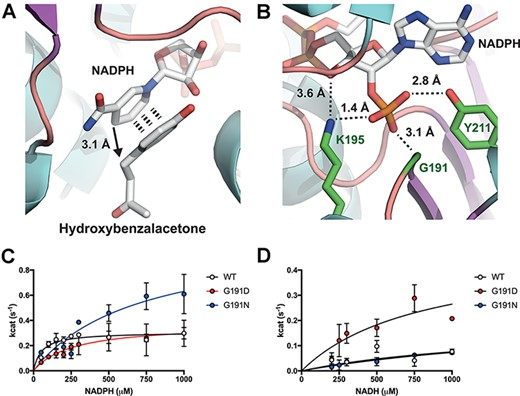
图4 基于结构工程的RZS1还原酶的NADH特异性增加(pdb: 6EOW)。A.接近NADPH辅助因子的HBA的结合位点。B.辅助因子特异性是由G191, K195和Y211三个结合残基提供的,它们与5个ʹ-磷酸核糖氢键结合。C. RZS1 G191异构的NADPH动力学。D. RZS1 G191异构的NADH动力学。
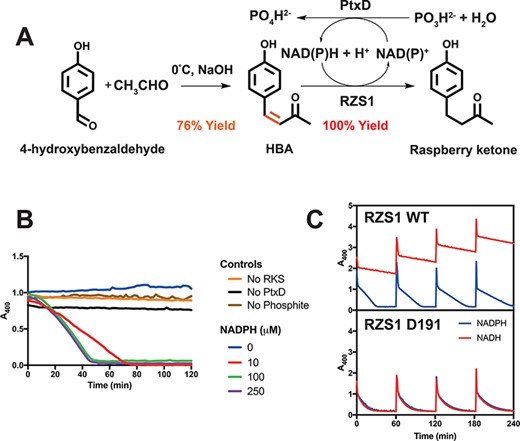
图5 利用NADH和辅助因子再生两步法合成覆盆子酮。A.一种利用醛醇缩合和RZS1还原酶活性及辅助因子再生的覆盆子酮半合成途径。B.高温PtxD opt12亚磷酸脱氢酶的活性:1 mM HBA和10 μM RZS1。阴性对照(无酶或亚磷酸)与不同浓度的NADPH一起显示。C. 400 nm时程反应监测吸光度损失,显示对羟基苯甲醛(HBA)还原为覆盆子酮。每60分钟注射1 mM HBA。过量的PtxD和20 mM亚磷酸盐与10 μM RZS1(上面板)或D191异构酶(下面板)在30°C孵育,与0.25 μM NADPH(蓝线)或NADH(红线)。
无细胞合成生物学和合成生物化学的相关领域提供了一个令人兴奋的机会来设计和设计活细胞之外的酶途径。最近的进展包括合成CO2固定循环的产生和20 000 L的肌醇生物合成。天然产品和其他高价值的精细化学品通常只在其天然来源中以非常低的浓度合成。因此,人们对开发一系列高价值精细化学品的生物可持续合成路线的兴趣日益增加。至于覆盆子酮,树莓本身只合成了少量,而且这个过程需要数周的成熟期。虽然覆盆子酮中间体一般会抑制微生物生长,但使用大肠杆菌全细胞(固定相细胞)生物催化剂系统可以绕过这一过程,该系统的活性达到g/L级,但需要化学衍生的前体对羟基苯甲醛(HBA)。另外,可以从天然原料中提取的底物L-酪氨酸或对香豆酸盐,可以在本文所述的III型聚酮中,在合成工程大肠杆菌和酿酒酵母系统中转化,但由于一般毒性,产量有限(高达95 mg/L)。
在此,我们研究了一种可替代的无细胞“一锅”多酶系统的生物合成覆盆子酮。覆盆子酮是一种较为简单的聚酮类化合物,其生物合成途径仍然需要昂贵的辅助因子ATP、丙二酰辅酶a和NAD(P)H。通过研究细胞外的这个系统,可以精确控制酶水平,并灵活测试不同的辅助因子循环系统。我们证明了覆盆子酮可以从L-酪氨酸的五步法合成,但是,最经济的辅助因子NADH的产量有限。因此,为了降低关键的成本因子NADPH,我们的工作重点是放松RZS1双键还原酶对NADH的辅助因子特异性。许多研究强调,NADPH氧化还原酶可以被设计成使用更稳定和廉价的NADH或仿生类似物。作为一种广义的方法,NAD(P)H酶的结构导向设计可以通过改变对核糖5ʹ-磷酸(NADPH)或羟基(NADH)基团的亲和力来实现。在RZS1酶的情况下,G191的空间结构为结合特异性宽松的辅助因子提供了灵活的控制。它通过亚磷酸脱氢酶与廉价的磷酸盐供体结合使用,从而提供了在无细胞条件下利用NADH使用所述的三种起始底物中的任何一种低成本合成覆盆子酮的途径。重要的是,RZS1 G191D异构酶在低水平的NADH (10 μM)下是有效的,并能保持数天的活性。通过将该酶代入完整的“一锅”多酶体系,我们可以在一个批处理体系中获得61 mg/L的覆盆子酮,底物L-酪氨酸(300 μM或54 mg/L)完全转化为覆盆子酮。在较高浓度的L-酪氨酸,尽管试图优化辅助因子和ATP水平(数据未显示),我们观察到合成途径上的中间体和副产物bisnoryangonin的积累。最后,我们也证明了一种有效的两步化学酶法合成覆盆子酮。这类似于Yang等人所采用的策略,即由于化学合成对羟基苯甲醛HBA的要求,获得了“天然等同”且经济价值较低的产品。因此,如果可扩展性得到证明,制备天然覆盆子酮的五步法将更有意义。然而,需要进一步的亚苄基丙酮合成酶(benzalacetone synthase, BAS)酶工程,表征新的亚苄基丙酮合成酶同源物,或开发替代的酶途径。这是因为在我们优化的反应中,亚苄基丙酮合成酶的催化活性是限速的,而且它还会产生一种不希望的副产物bisnoryangonin。
虽然全面的技术经济分析超出了目前工作的范围,但用无细胞酶的方法进行精细化学合成可以在可持续性方面提供好处。目前,用于化妆品和食品添加剂的精细化工市场中,大约80%是由石油衍生的化学合成生产的,因此,如果声明为“天然等同”,就可以被批准使用。因此,对于从需要大量农业用地的食物来源中自然提取的精细化学物质,通过使用转基因植物和微生物或通过扩大无细胞系统,设计更绿色的替代生物催化平台可能更简单、更可持续。与全细胞生产工艺相比,使用纯化酶可能在控制副反应方面提供好处,由于较少的代谢物污染而易于纯化,或在产品毒性限制细胞生长的情况下。然而,酶生产和纯化的成本,以及添加昂贵的辅因子(通常由细胞内的培养基成分产生)的需要,确实导致了成本的增加。诸如酶的固定化以实现回收和再利用的策略,可能被用来实现经济可行性。
在这里,我们使用覆盆子酮作为一个模型途径,展示了一个明显的非生产性酶途径可以从细胞外设计到一个高水平产量的性能。这一过程的关键是在完成过程中研究途径酶的能力,而不是作为单个不耦合动力学,因为共享资源(CoA, ATP)可以影响总产量。总之,无细胞合成生物学提供了一个可扩展的机会来设计合成酶的合成器与辅助因子的有效性一致。我们已经应用这种合理的方法来优化覆盆子酮,这是一种小分子,不易从工程活细胞中获得。在未来,具有高度稳定和活性酶的大规模无细胞工程方法,有潜力在与传统的细胞工程竞争中发挥更广泛的作用,特别是在高价值的精细化学品、重组蛋白和天然产品方面。
覆盆子酮的药理活性
1、覆盆子酮作为天然抗氧化剂的潜力 [4]
氧化应激与各种疾病密切相关,许多研究已经确定如何减少这种应激。特别是,人们正在努力从天然产品中寻找潜在的抗氧化剂。研究表明覆盆子酮(RK;4-(4-羟基苯基)-2-丁酮具有多种药理活性。本文就RK的抗氧化活性及其作用机制进行综述。在几个实验模型中,证明了RK通过增加总抗氧化能力(TAC)来显示抗氧化性能;上调抗氧化酶,如超氧化物歧化酶(SOD)和过氧化氢酶(CAT);改善脂质过氧化。综上所述,RK抗氧化活性的研究与其他各种生理活性有直接或间接的关系。进一步的临床研究将证实RK作为一种有效的抗氧化剂、功能性保健食品和治疗剂的价值。
还需要对RK的安全性和毒性进行更广泛的评价。根据调味料制造商协会(FEMA)的标准,RK被授予GRAS(公认为安全)地位,并被美国食品和药物管理局(FDA)批准用于食品用途(21 CFR 172.515),对公众健康没有危害。RK对雄性和雌性大鼠急性口服半数致死量(LD50)分别为1.32 g/kg和1.40 g/kg。此外,除了短暂的血红蛋白下降外,喂食0.1-1.0% RK的饲料13周后,所有大鼠均未出现明显的亚急性毒性,包括体重增加。根据这些数据,RK目前作为一种减肥膳食补充剂在市场上销售,推荐剂量为100 - 1400毫克/天。然而,一些研究人员仍然警告过度使用RK补充剂的风险,因为RK的安全性和毒性尚未得到充分评估,特别是在高剂量情况下。在最近的一项研究中,急性单次口服640mg/kg RK可引起C57BL/6J小鼠的各种病理改变,包括白色脂肪组织萎缩、脾异常、胸腺退化和某些血液学值升高。进一步研究RK的慢性毒性及其对人体的有害影响,将有助于建立更安全的临床使用RK的给药方案。
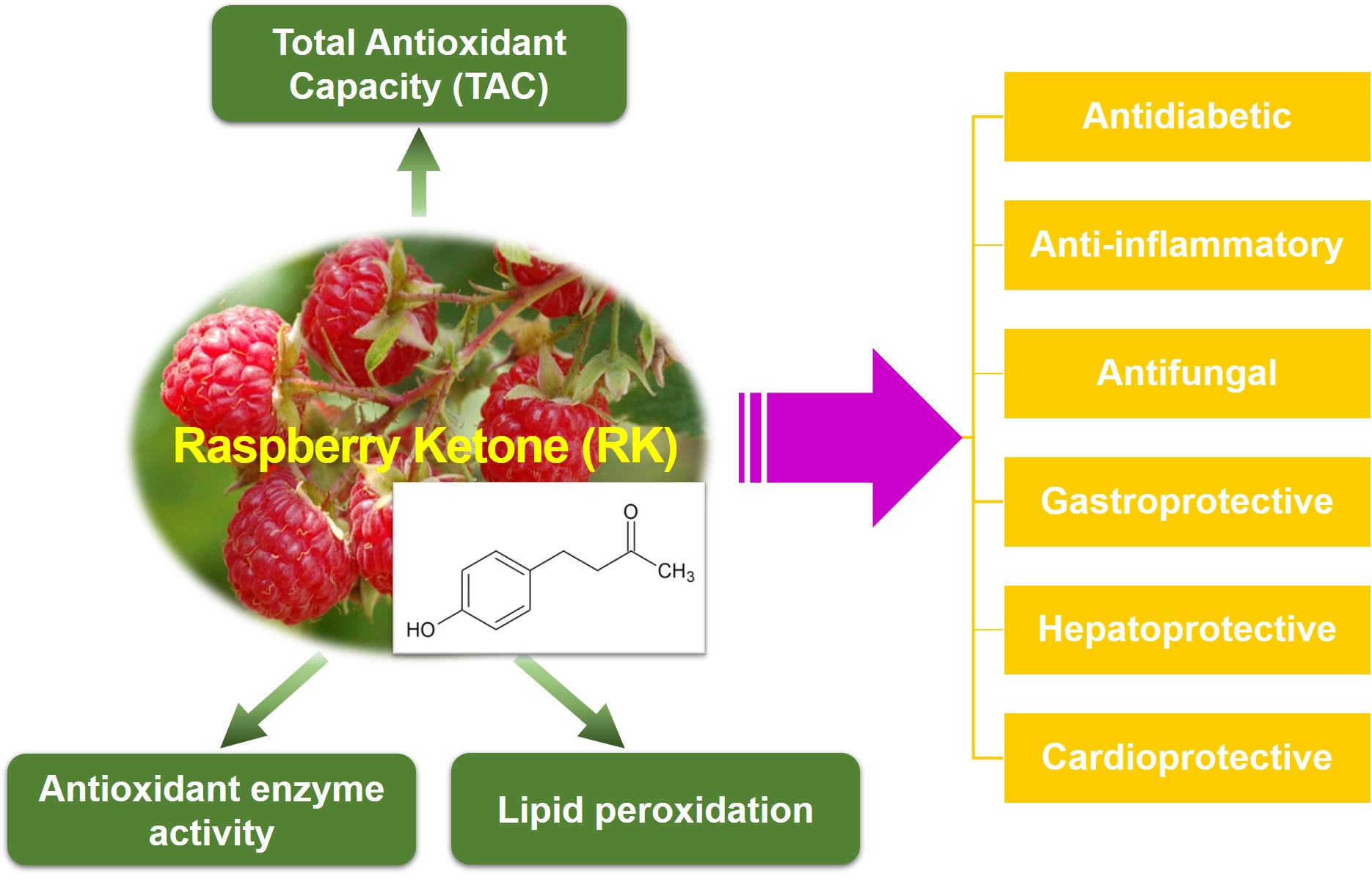
图6 覆盆子酮的生物活性示意图
2、覆盆子酮的潜在代谢活性 [5]
近年来,新型食品和食品复合干预手段在预防和治疗代谢性疾病方面引起了人们的广泛关注。覆盆子酮(RK)是一种芳香化合物,存在于红色水果和浆果中,已被用作非处方药的减肥产品。然而,实际上,RK对减肥的影响仍存在争议,其机制在很大程度上还不清楚。此外,体内和体外研究表明,RK对其他代谢性疾病的发展具有有益作用。本文综述了RK的合成、生物利用度、代谢等方面的研究进展,并对其抗肥胖、抗糖尿病、保护心脏、保护肝脏等潜在生物活性及其作用机制进行了综述。本文概述了目前的研究结果,并提出了RK在人类健康领域的未来研究。覆盆子酮(RK)被用于控制体重已有多年,但考虑到食物摄入量,这种效果存在争议。此外,RK对T2DM、肝和心脏损伤也有好处。RK的保护作用机制包括促进脂肪酸氧化、平衡血糖水平、抗炎、抗氧化等。在这方面,我们对RK对许多代谢性疾病的益处进行了全面的分析,并讨论了其潜在的分子机制。希望我们的工作对进一步研究RK,提高公众对RK的认识有所帮助。
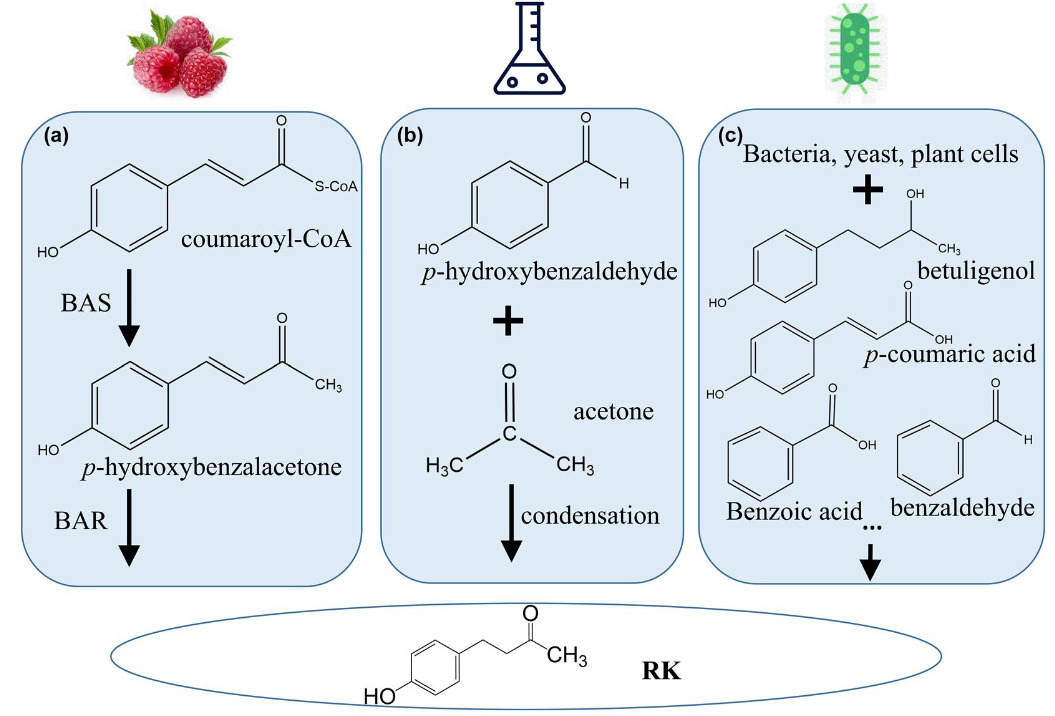
图7 植物,化学和微生物合成覆盆子酮的反应路径

图8 老鼠胞浆中覆盆子酮的转化及其主要代谢产物
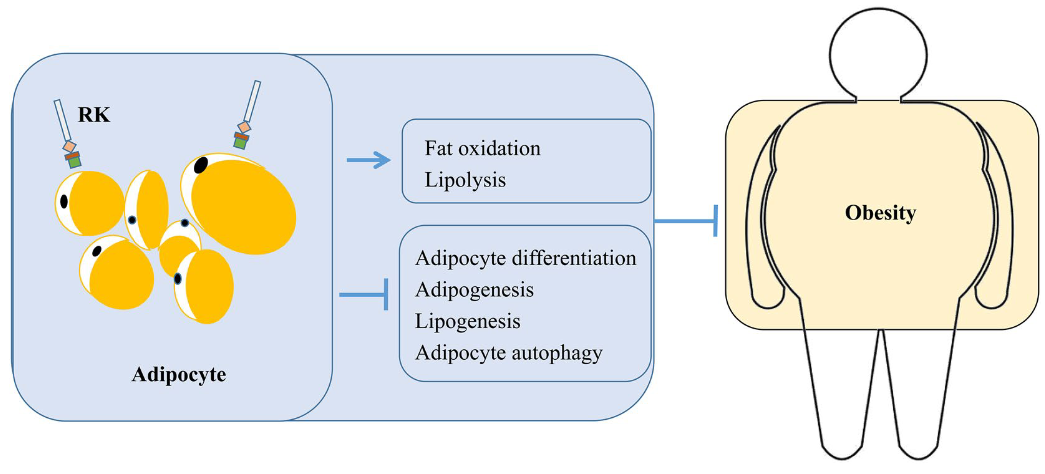
图9 覆盆子酮通过调控脂肪细胞来控制人的体重
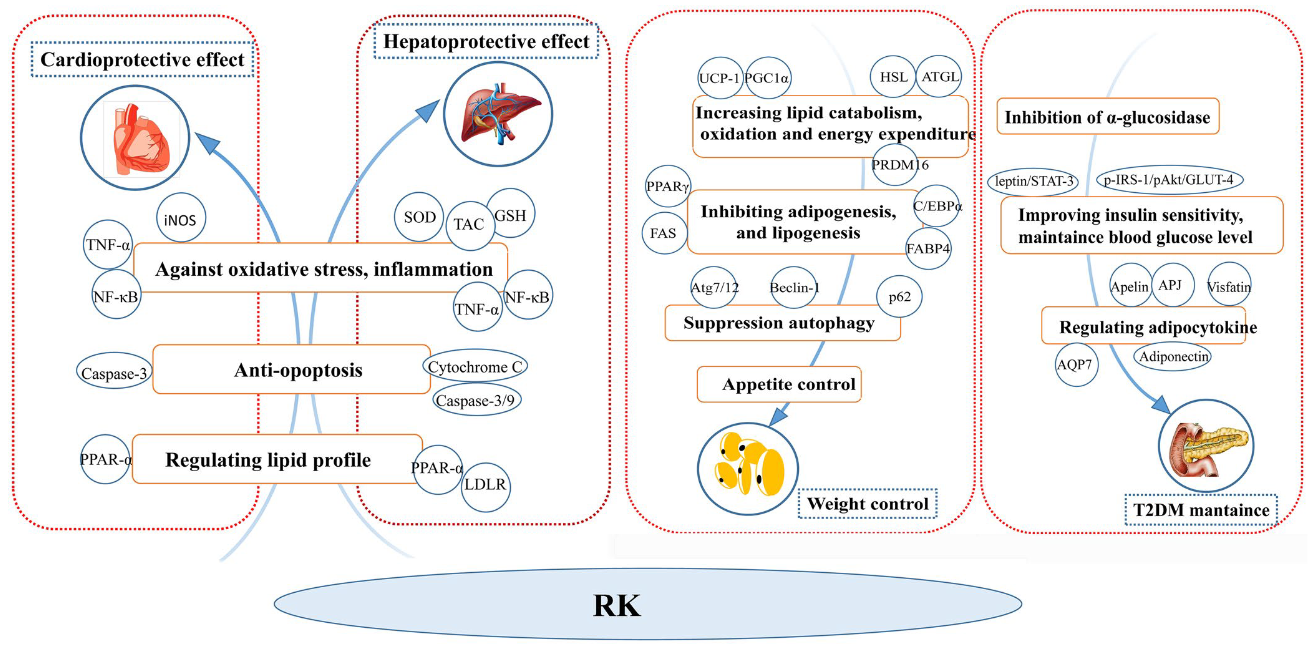
图10 覆盆子酮在代谢性疾病中的作用
3、酚类化合物药理研究:覆盆子酮2020年更新 [6]
覆盆子酮(RK)是一种芳香酚类化合物,天然存在于红树莓、猕猴桃、桃子和苹果中,并被报道具有潜在的治疗和营养特性。细胞和啮齿类动物的研究表明,RK在肝脏/心脏/胃的保护中发挥重要作用,并作为一种抗高脂血症、抗肥胖、脱色和性成熟剂。覆盆子酮介导的过氧化物酶体增殖物激活受体-α (PPAR-α)的激活是其主要的作用方式之一。虽然啮齿类动物研究已经证实了RK的有效作用,但其作用机制仍在很大程度上未知。尽管缺乏可靠的人体研究,RK作为一种健康补充剂在市场上销售,剂量非常高。在这篇综述中,我们提供了迄今为止进行的科学研究的汇编,评估RK在几种疾病条件下的治疗特性,并在RK被认为是治疗主要生活方式疾病的一种安全有效且副作用有限的替代药物之前,启发未来的研究。
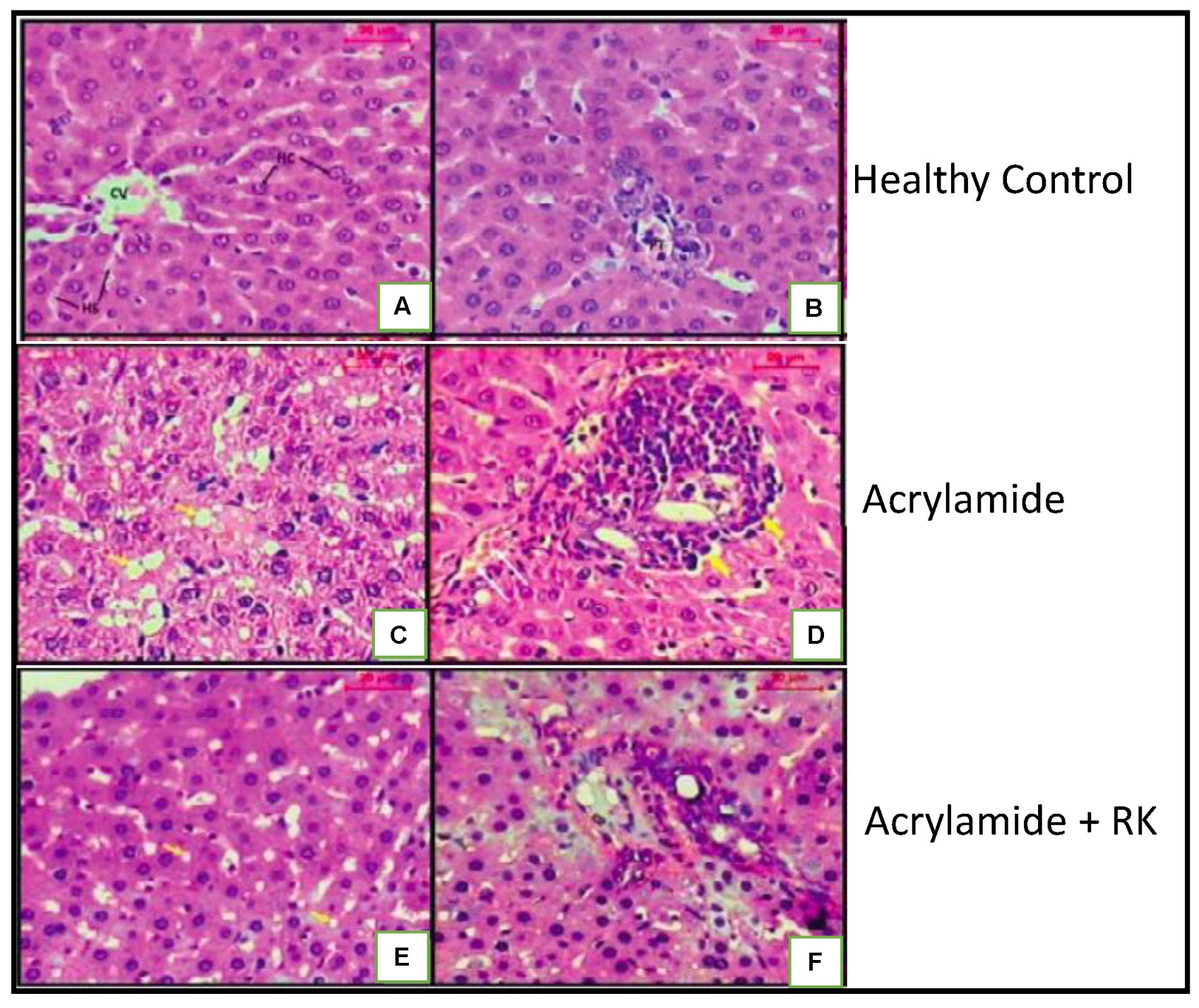
图11 RK介导的丙烯酰胺性肝病大鼠肝脏保护作用健康对照组肝脏切片的显微照片(A,B),显示正常的肝小叶结构。中央静脉被肝细胞、肝窦和正常的门静脉所包围。(C,D)丙烯酰胺处理组肝切片显示肝小叶紊乱,肝细胞内空泡,门静脉内大量淋巴细胞浸润,门静脉周围腔扩张充血。(E,F) RK-丙烯酰胺处理组的肝小叶看起来或多或少像正常;门管区伴轻度浸润,肝细胞基本正常。他走时染色;比例尺:20mm。
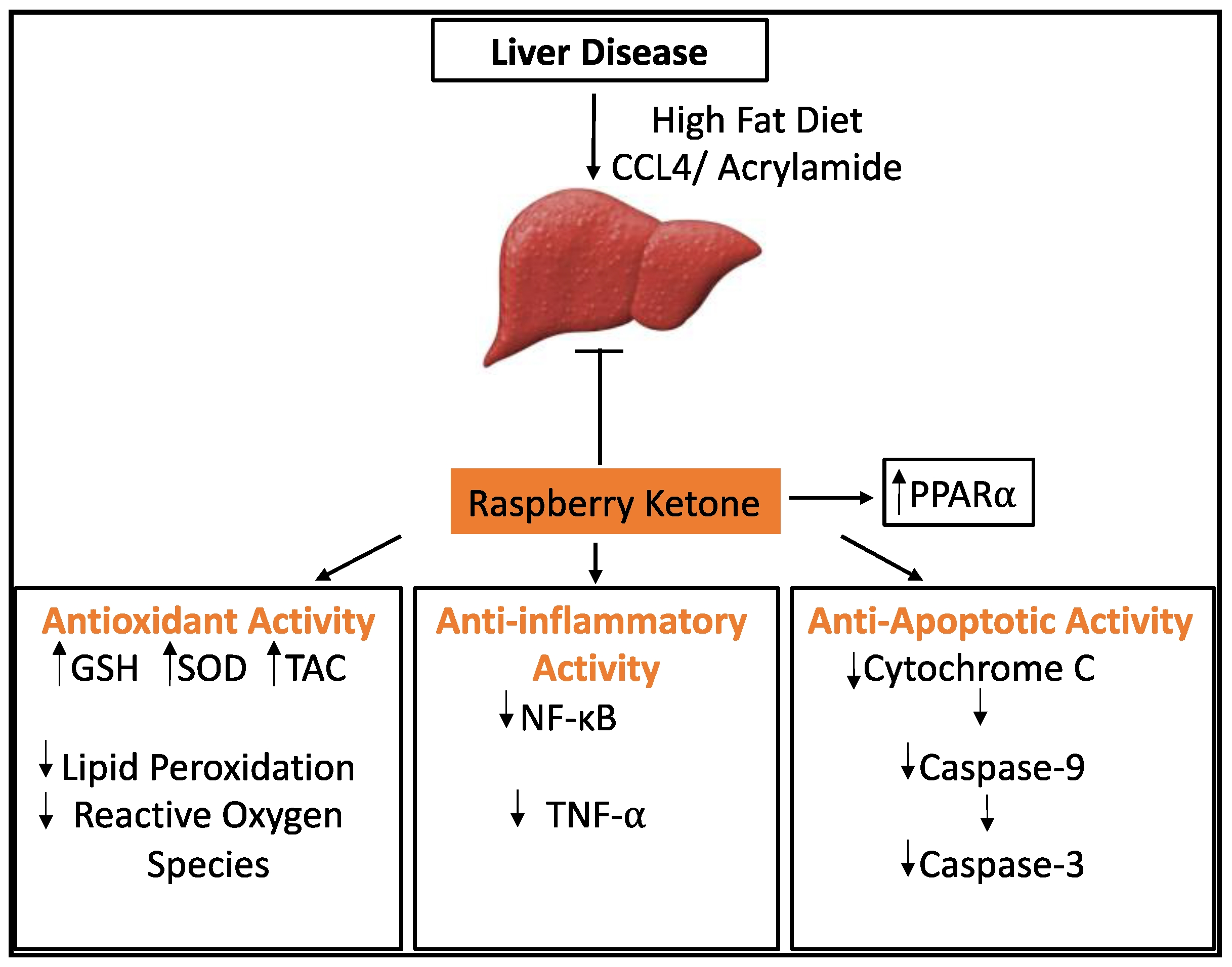
图12 RK对由高脂肪饮食、CCL4或丙烯酰胺引起的肝脏疾病的保护作用。
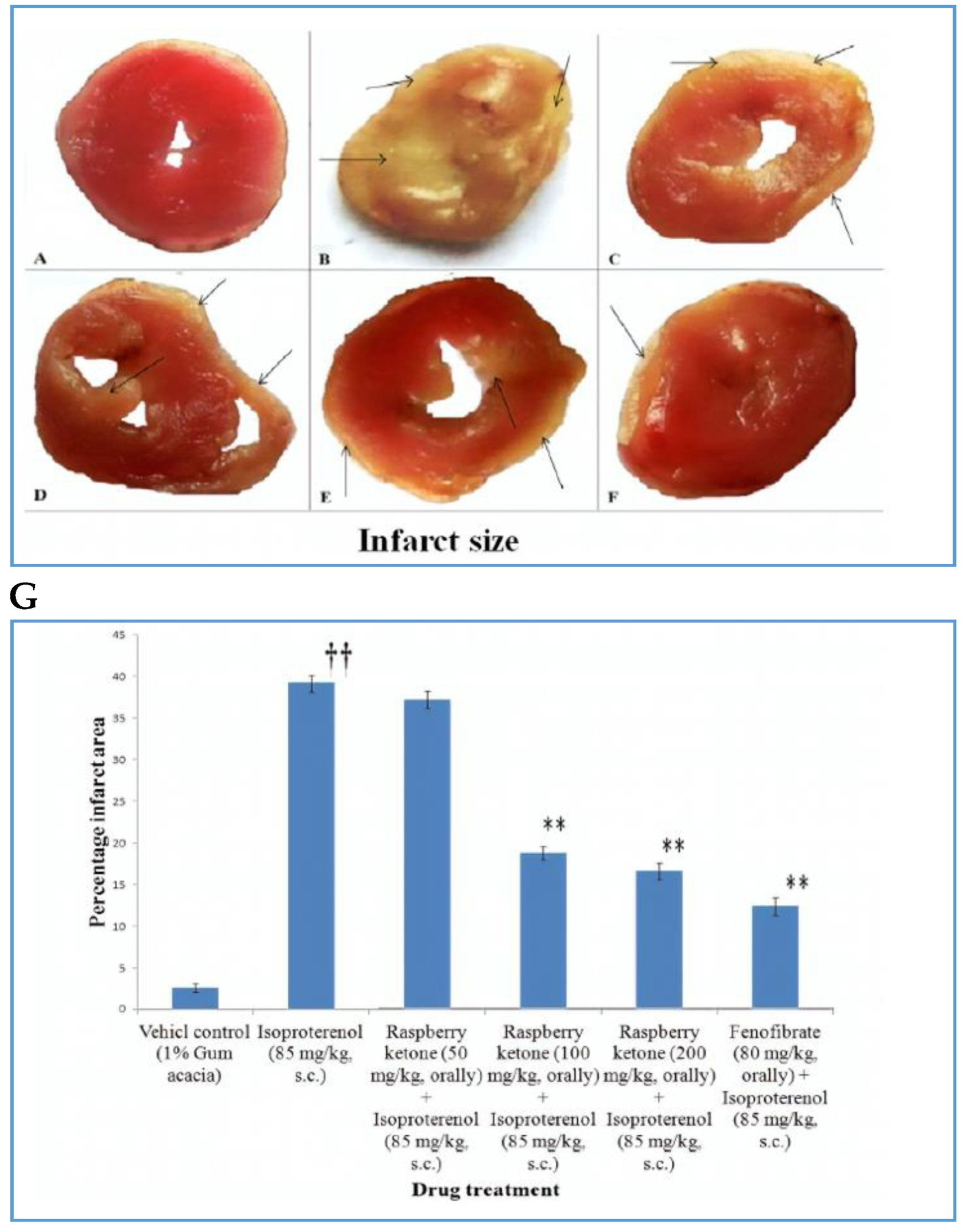
图13 RK及不同药物对各组心肌梗死面积的影响(箭头所示)。(一)空白对照阿拉伯树胶(1%),(B)异丙肾上腺素(85毫克/公斤,南卡罗来纳州)(C) RK(50毫克/公斤,口服)+异丙肾上腺素(85毫克/公斤,南卡罗来纳州)(D) RK(100毫克/公斤,口服)+异丙肾上腺素(85毫克/公斤,南卡罗来纳州)(E) RK(200毫克/公斤,口服)+异丙肾上腺素(85毫克/公斤,南卡罗来纳州)(F)和非诺贝特(80毫克/公斤,口头)+异丙肾上腺素(85毫克/公斤,南卡罗来纳州)。图中为不同处理组的梗死面积百分比(G),各柱为平均扫描电镜(SEM)。通过单因素方差分析(one-way ANOVA)和Dunnett t检验确定显著性:** p < 0.01与毒性对照;††p < 0.01与空白对照。
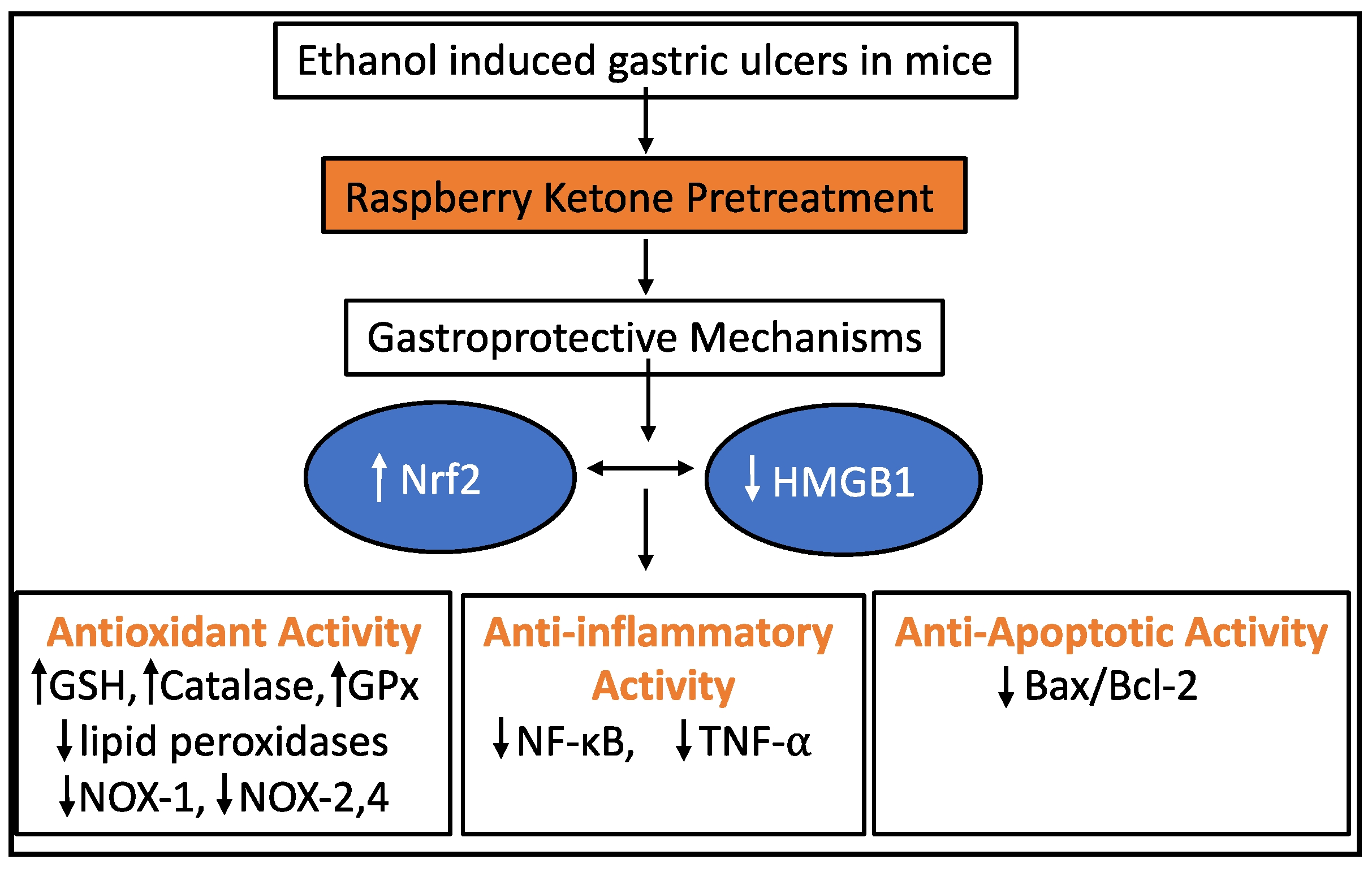
图14 RK对乙醇诱导的大鼠胃溃疡的胃保护作用的不同分子靶点示意图。

图15 示意图显示黑色素细胞产生黑色素和RK对黑色素合成的影响,导致色素脱失(美白)。
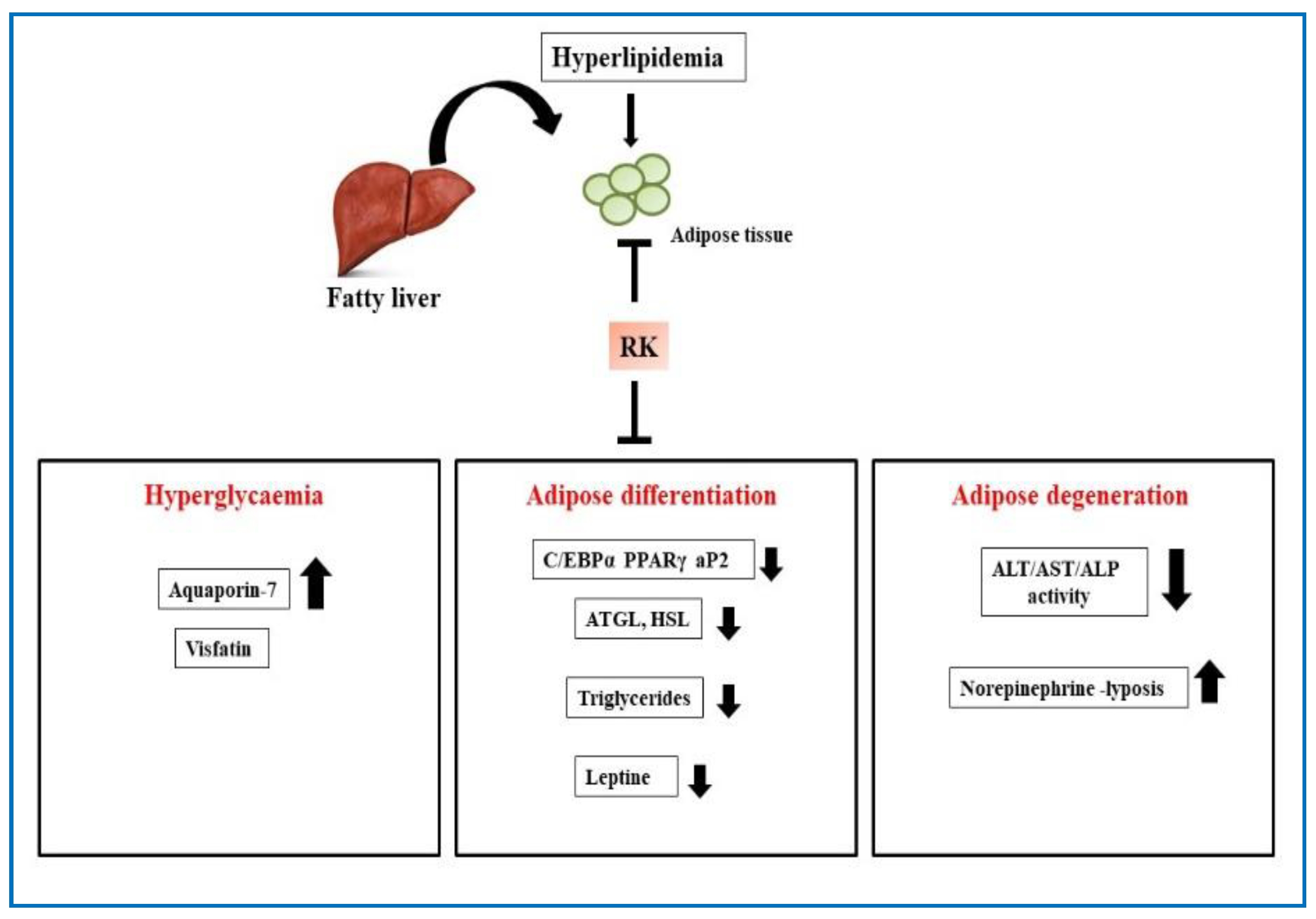
图16 RK治疗高脂血症疗效示意图。
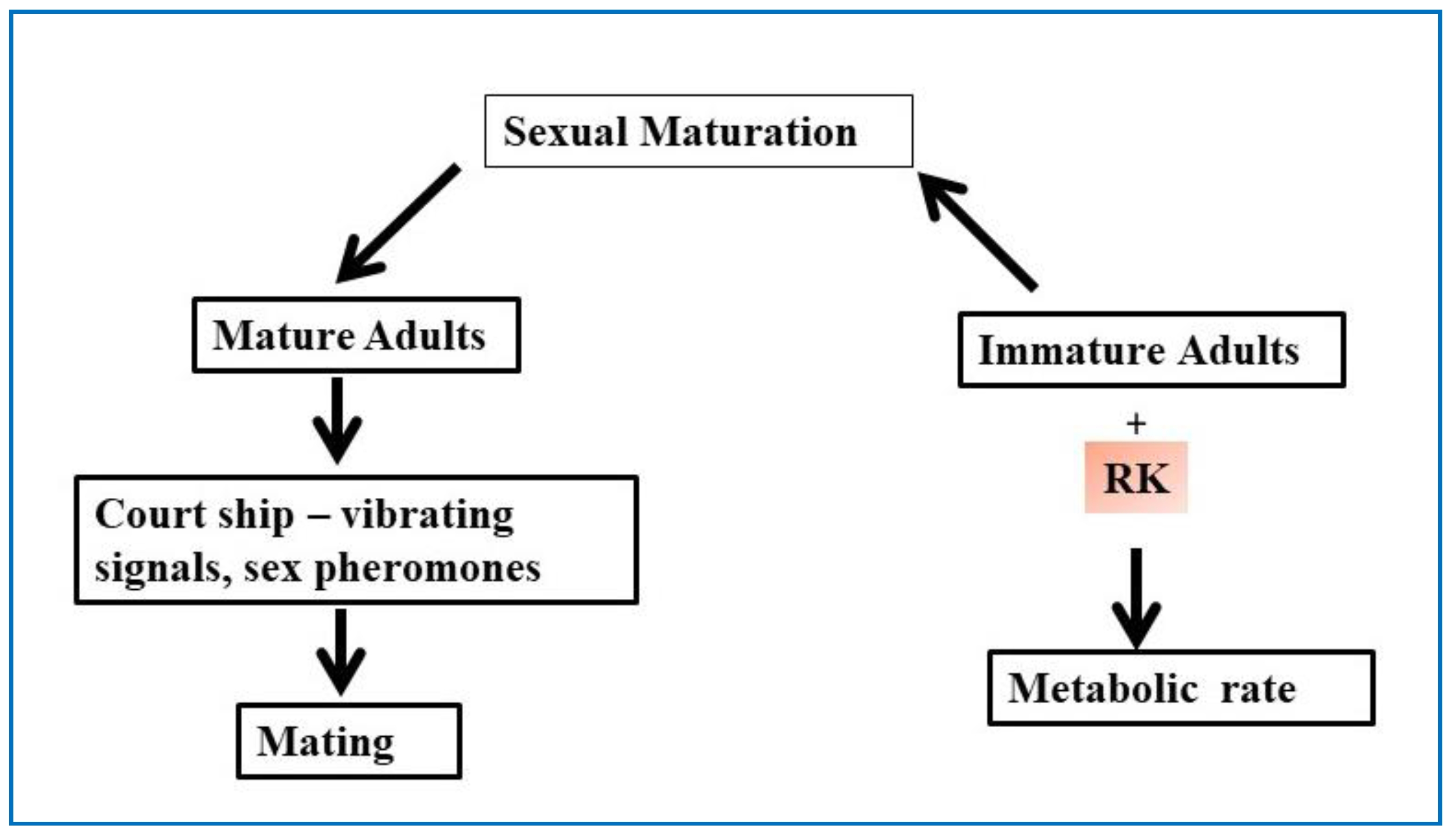
图17 图示昆虫交配过程及RK在性成熟中的作用。
全世界对营养药品的研究、生物活性成分的药理探索及其治疗各种疾病的潜力越来越感兴趣。初步的体外和体内动物研究表明,RK在保护肝脏、保护心脏、治疗胃溃疡和肥胖等方面具有有益作用。然而,要将RK作为一种治疗性分子,还需要进行大量的研究来确定其疗效和作用机制。诚然,在未来的角度来看,RK可以被认为是导致一部分,识别并视为植物成分风格多样化,有大量的治疗和营养价值,但需要更严格的安全性和毒理学研究。覆盆子酮可以被认为是疾病治疗前的预防性健康原料。我们希望目前对RK的全面综述将作为基础数据,以鼓励对这一关键生物分子的进一步详细研究,并使研究人员进一步探索和解开RK的其他特性,以帮助未满足的临床需求。
参考文献
[1] Bo Yang, Pu Zheng, Dan Wu, and Pengcheng Chen. Efficient Biosynthesis of Raspberry Ketone by Engineered Escherichia coli Coexpressing Zingerone Synthase and Glucose Dehydrogenase. J. Agric. Food Chem. 2021, 69, 8, 2549–2556. https://doi.org/10.1021/acs.jafc.0c07697
[2] Häkkinen Suvi T., Seppänen-Laakso Tuulikki, Oksman-Caldentey Kirsi-Marja, Rischer Heiko. Bioconversion to Raspberry Ketone is Achieved by Several Non-related Plant Cell Cultures. Frontiers in Plant Science, 2015, 6, https://doi.org/10.3389/fpls.2015.01035.
[3] Simon J Moore, Tommaso Tosi, David Bell, Yonek B Hleba, Karen M Polizzi, Paul S Freemont, High-yield ‘one-pot’ biosynthesis of raspberry ketone, a high-value fine chemical, Synthetic Biology, Volume 6, Issue 1, 2021, ysab021, https://doi.org/10.1093/synbio/ysab021
[4] Lim SH, Choi C-I. Potentials of Raspberry Ketone as a Natural Antioxidant. Antioxidants. 2021; 10(3):482. https://doi.org/10.3390/antiox10030482
[5] Xiaoping Li,Teng Wei,Min Wu,Fang Chen,Peng Zhang,Ze-yuan Deng,Ting Luo. Potential metabolic activities of raspberry ketone. Journal of Food Biochemistry, 2022, 46(1),e14018. https://doi.org/ 10.1111/ jfbc. 4018
[6] Rao, Shailaja & Kurakula, Mallesh & Mamidipalli, Nagarjuna & Tiyyagura, Papireddy & Patel, Bhaumik & Manne, Ravi. (2021). Pharmacological Exploration of Phenolic Compound: Raspberry Ketone—Update 2020. Plants. 10. 1323. 10.3390/plants10071323.

香精是化妆品应用广泛的原料,赋予化妆品特殊气味,使产品气味怡人、舒适,提高产品使用体验感。但是为什么市场面上越来越多的化妆品标榜着“无香精”、“无香型”?什么是...
2023-02-27(日用)香精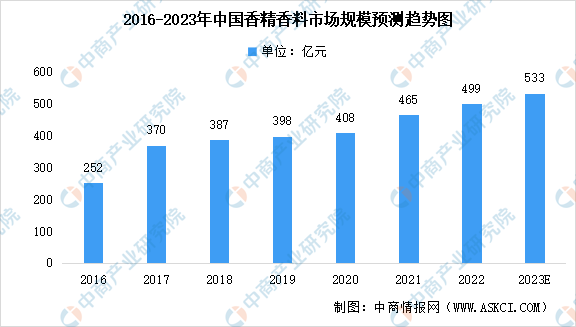
中商情报网讯:香料是一种能被嗅感嗅出气味或味感尝出香味的物质;香精则是由多种香料、溶剂或载体及其辅料调配而成的芳香类混合物。香精香料下游应用领域广泛,是食品、饮...
2023-02-21中商产业研究院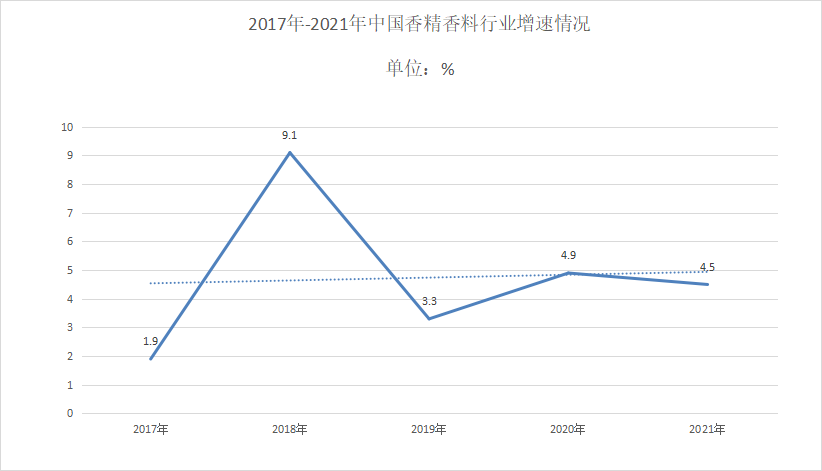
中国报告大厅网讯,香精香料行业的发展与国民生活水平和消费水平紧密相关,香精香料的发展与国家有关利好政策分不开。目前我国高端香精香料市场发展潜力大,产品也逐渐往高...
2023-02-20报告大厅(www.chinabgao.com)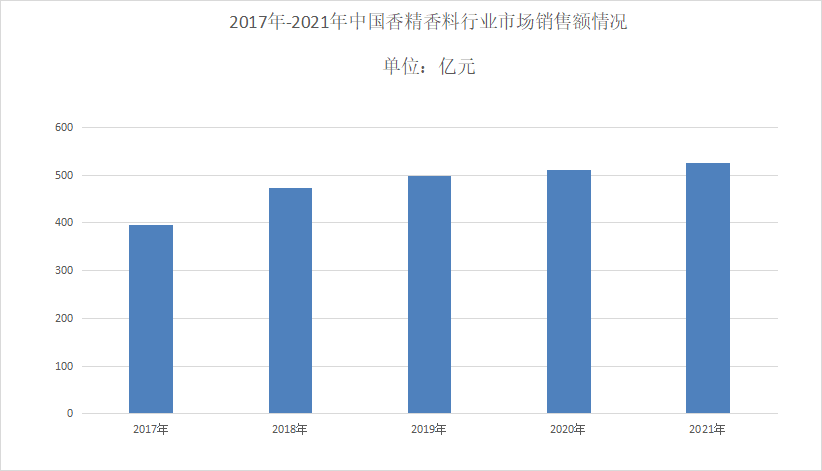
中国报告大厅网讯,香精香料应用领域广泛近些年国内产量和销售额均呈现持续增长的趋势,并且香精香料在国民经济中有着重要地位。目前香精香料市场发展较快行业逐渐往高质量...
2023-02-20报告大厅(www.chinabgao.com)
用感官方法来辨香与评香是日用调香术中在识辨、评比或鉴定香料或香精或加香制品的香气(或香味,下同)的过程中不可缺少和不能忽略的手段和方法。辨香是识辨香气,评香是对...
2023-02-17厦门香精公司